- 1.タンパク質の動きから探るからだの仕組み
- 2.自己免疫疾患の新しい発現機構を発見
- 3.T細胞の活性化のしくみ
- 4.自己免疫はどうして起こる?
- 5.ガンは免疫でやっつけられる?
- 6.抗原提示経路
- 7.X線1分子追跡法
- 8.蛍光寿命測定法
研究をもっと詳しく知るために
1. タンパク質の動きから探るからだの仕組み
はじめに
体の中で、生命機能維持をしているのはタンパク質です。タンパク質は一時構造情報に従い、ある一定の形をとり、その形によって様々な働きを体の中ですると考えられます。タンパク質表面はでこぼこしていたり、電気的にプラスだったりマイナスだったりとタンパク質ごとにその表情が異なり、それ故に反応できる相手の分子は限定されることになります。つまり、存在そのものが情報を持っているわけです。一方、タンパク質は固いわけではなく、ある程度その構造に柔軟性があります。タンパク質は、構造と柔軟性をうまく組み合わせることで、それ以外の物質ではなしえない機能を持つのです。
最近まで、この柔軟性はあまり重要視されてきませんでした。というのは結晶解析学から出てきた構造が非常に精密で、それだけで多くのことが解明されたからです。しかしながら、結晶解析で出てきた構造が唯一の構造ではなく、いくつも構造中間体があることが解ってきました。タンパク質は、そういう構造の間をゆらいでいるわけです。相互作用する相手がたまたま結合できる状態のものを見つけると、さらにタンパク質の構造が誘導適合していくと考えられます。我々は、免疫系のタンパク質をモデルとして、最先端の計測技術でタンパク質の微細な動きを実測し、それが如何に機能に影響するか研究しています。
免疫における認識とは
免疫学は、体内に入ってきた異物を識別し排除する仕組みを研究する学問です。異物の認識はさまざまな種類の受容体が担っていますが、その中のT細胞受容体(TCR)はT細胞の細胞膜上にあり、抗原提示細胞上に存在する抗原を認識します。この時、抗原と一緒に自分のタンパク質である主要組織適合性抗原(MHC)分子も一緒に見ます。他の多様な異物を認識する分子としては抗体があります。抗体は直接、抗原分子を包み込むようにして結合します。また免疫系以外のタンパク質相互作用はほとんどが直接相手の分子と接触します。
ところがT細胞の認識の仕方は異なるわけです。MHC分子との組み合わせでないと認識されません。これは、他の分子認識、あるいは相互作用には例を見ない特殊な方式です。MHC分子は臓器移植のときに移植を拒絶するタンパク質として見つかりました。
MHC分子の役割は細胞内にある異物の一部を細胞表面まで運び細胞外に提示することです。細胞の中では、バクテリアやウイルスの死骸が分解され小さな断片(ペプチド)になります。それをMHCは捕まえ細胞表面にもっていくわけです。その断片が、自分のタンパク質由来でなく、かつ同時に微生物が進入した形跡があるとT細胞は活性化し、異物の排除を始めます。また、自分の体由来の物質とは反応しないようにする仕組みがあります。その中の1つが胸腺における負の選択です。胸腺では自分の体由来のタンパク質抗原が提示されます。それと反応するT細胞は除去されるのです。
最近、1種類のペプチド/MHC複合体が複数の顔を持つことが解ってきました。1つの複合体がいくつもの構造を示して、それぞれに対応する認識をするT細胞の存在が明らかになってきたのです。それらのT細胞の中に、先に述べた胸腺での負の選択を免れるものも出てくることが解ってきました。これは一大事です、なぜならそういうT細胞は自分の細胞を攻撃する可能性が大きいからです。そこで、どのような構造のバリエーションをペプチド/MHC複合体がとるのかということが疑問となりました。
タンパク質動態の測定法
タンパク質の動きを測定する方法としてはX線1分子追跡法(Diffracted X-ray Tracking: DXT)を用いています。生命現象の最小単位である素過程を理解するためには、タンパク質分子が機能発現する際に起こる分子内部の構造変化をマイクロ秒の高速性、かつÅ以下の高精度性を持って検出することが重要です。
DXTでは直径数十nm の極微ナノ結晶をタンパク質分子にその機能を損なわないように標識し,標識結晶からのX線回折斑点を指標に,タンパク質分子の動きを時分割的に追跡します。目的1 分子の一部に構造変化が起こるとその部位に標識されているナノ結晶が分子内部の構造変化と同期し方位が変化しナノ結晶からの回折斑点の位置が動きます。標識されたナノ結晶は,非標識体のタンパク質分子の微細な運動様式を追随して運動してくれるというわけです。
ペプチドの動きがT細胞の認識を変える
ペプチド/MHCの動きを計測すると結合したペプチドの長さが短い時と長い時で χ方向の速度に差が出てくることが解りました。つまり新たな構造が出やすいペプチドと出にくいペプチドがあることが解ったのです。また結晶構造では非常に硬いと思われていた部分にゆらぎがあり、それがT細胞の認識構造を変えるということが解りました。
今後は、さらに計測の高速化を狙い、ペプチドとMHCの動きを同時に測定できる方法を確立していく予定です。また、自己免疫を起こしやすいペプチド/MHCの動きを基に、それを逆にがんを標的とした免疫療法として利用することを目論んでいます。
2. プレスリリース「自己免疫疾患の新しい発現機構を発見!」
1.発表のポイント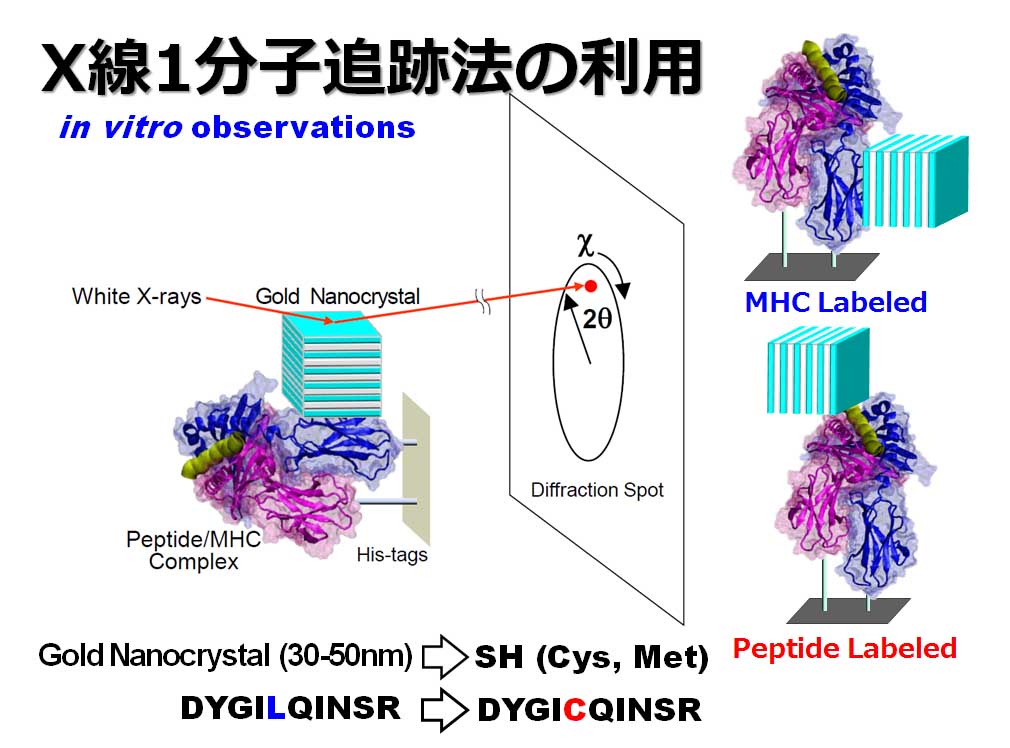 ◆主要組織適合性抗原(MHC)上に提示される病原体由来のタンパク質断片(抗原ペプチド)の1分子内部動態を高速X線回折像からリアルタイム動画撮影に成功。
◆主要組織適合性抗原(MHC)上に提示される病原体由来のタンパク質断片(抗原ペプチド)の1分子内部動態を高速X線回折像からリアルタイム動画撮影に成功。
◆抗原ペプチド1分子内部動態はMHC本体の分子動態と独立であることを実証。
◆自己免疫疾患を起こす抗原ペプチドは分子内部動態が激しく、新たな認識構造を生み出す可能性があるため、この動きを制御できれば、新しい免疫病予防法が実現可能。
2.発表概要: 東京理科大学生命医科学研究所の小園晴生准教授と東京大学大学院新領域創成科学研究科の佐々木裕次教授を中心とする研究グループは、体内に侵入した病原体を免疫細胞に提示する分子である主要組織適合性抗原(MHC)分子が、病原体由来のタンパク質断片(抗原ペプチド)とどのように結合し、免疫応答を活性化しているかを、SPring-8 BL40XUビームラインで1分子内部動態測定をすることにより、世界で初めて実験的に明らかにした。 自己免疫を起こしやすい抗原ペプチドは、ゆるくMHC分子と結合することが以前より知られていた。しかし、このゆるい結合が免疫応答の分子認識機構にどう関わっているか実験的にはわからなかった。本研究成果により、抗原ペプチドの分子軸に対して回転方向の動きが特に活発化し、抗原ペプチドとMHCの複合体が新たな構造をとり、潜在的自己反応性のT細胞と反応することが分かった。 研究グループは、マウスのMHC分子に14個のアミノ酸からなる「長い抗原ペプチド」と10個のアミノ酸からなる「短い抗原ペプチド」が結合している場合のそれぞれの分子内部動態を、高精度と高速性を持ち合わせる唯一の1分子計測法であるX線1分子追跡法(DXT)、抗原ペプチド1分子動態の計算、多分子からの蛍光偏光解消法を用いて調べた。その結果、MHC分子とゆるく結合する「短い抗原ペプチド」は「長い抗原ペプチド」よりMHC分子内でよく動き、新たな構造をとっていることが明らかになった。
3.発表内容: 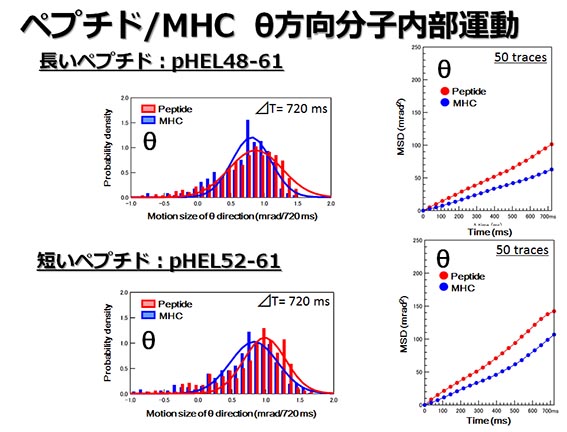 MHC分子は細胞内にある抗原ペプチドと結合してそれを細胞表面まで運び、免疫細胞の一種であるT細胞に提示するタンパク質分子である。抗原ペプチドと結合したMHC分子(抗原ペプチド/MHC複合体)をT細胞上のT細胞受容体が認識すると体内の免疫応答が始まる。最近、たった一つの抗原ペプチドと結合したMHC分子が抗原性(複数のT細胞と特異的に認識して結合する性質)を示すことが明らかになり、それぞれを認識するT細胞の存在が明らかになった。研究グループは、MHCと結合する部分のアミノ酸配列は同じだが、MHC分子のペプチド収容溝と同じ長さの「短い抗原ペプチド」と、それよりも4残基長い「長い抗原ペプチド」を準備した。この2つのペプチドの分子内部動態を、DXTと蛍光偏光解消法、そして分子動力学計算を用いて比較することでT細胞の認識の違いを明らかにできると予測した。
DXTは、数十nm(ナノメートル)の超微小金ナノ結晶を観察タンパク質分子に化学的に標識し、分子内部運動に連動した標識(ナノ結晶)の動きをX線回折斑点の動きとして高速時分割追跡する1分子動画計測手法である。この1分子計測手法は、現在、世界最高精度で最高速度を誇る1分子動画計測手法である。
今回、マウスのMHC分子MHC I-Akにニワトリ卵白リゾチームタンパク質由来の長さの異なる2つの抗原ペプチドを結合させ、MHC分子自体の動きを観察し、またそのペプチド上のT細胞受容体の認識部位に変異(システイン残基)を入れ、そこにナノ結晶を結合させ抗原ペプチドの分子内部動態を観察した。その結果、抗原ペプチドとMHC分子は非常に似通った動きをするが、抗原ペプチドの動きの方がMHC分子より大きく、独立した動態をしていた。また複数のT細胞を活性化する短い抗原ペプチドはMHC分子内で回転方向の動きがより大きいことが判明した。その動態は、抗原ペプチド/MHC複合体に新たな構造、つまり潜在的自己反応性のT細胞の認識できる構造を一時的に形成することを示している。
MHC分子は細胞内にある抗原ペプチドと結合してそれを細胞表面まで運び、免疫細胞の一種であるT細胞に提示するタンパク質分子である。抗原ペプチドと結合したMHC分子(抗原ペプチド/MHC複合体)をT細胞上のT細胞受容体が認識すると体内の免疫応答が始まる。最近、たった一つの抗原ペプチドと結合したMHC分子が抗原性(複数のT細胞と特異的に認識して結合する性質)を示すことが明らかになり、それぞれを認識するT細胞の存在が明らかになった。研究グループは、MHCと結合する部分のアミノ酸配列は同じだが、MHC分子のペプチド収容溝と同じ長さの「短い抗原ペプチド」と、それよりも4残基長い「長い抗原ペプチド」を準備した。この2つのペプチドの分子内部動態を、DXTと蛍光偏光解消法、そして分子動力学計算を用いて比較することでT細胞の認識の違いを明らかにできると予測した。
DXTは、数十nm(ナノメートル)の超微小金ナノ結晶を観察タンパク質分子に化学的に標識し、分子内部運動に連動した標識(ナノ結晶)の動きをX線回折斑点の動きとして高速時分割追跡する1分子動画計測手法である。この1分子計測手法は、現在、世界最高精度で最高速度を誇る1分子動画計測手法である。
今回、マウスのMHC分子MHC I-Akにニワトリ卵白リゾチームタンパク質由来の長さの異なる2つの抗原ペプチドを結合させ、MHC分子自体の動きを観察し、またそのペプチド上のT細胞受容体の認識部位に変異(システイン残基)を入れ、そこにナノ結晶を結合させ抗原ペプチドの分子内部動態を観察した。その結果、抗原ペプチドとMHC分子は非常に似通った動きをするが、抗原ペプチドの動きの方がMHC分子より大きく、独立した動態をしていた。また複数のT細胞を活性化する短い抗原ペプチドはMHC分子内で回転方向の動きがより大きいことが判明した。その動態は、抗原ペプチド/MHC複合体に新たな構造、つまり潜在的自己反応性のT細胞の認識できる構造を一時的に形成することを示している。
この事実を確認するために、多分子の平均的動態情報が得られる蛍光偏光解消法で2つの抗原ペプチドの運動に差が検出されるか調べ、同様に短い抗原ペプチドが速く動いていることがわかった。また、分子動力学計算の結果から、長い抗原ペプチドのうちMHC分子のペプチド収容溝に入りきらない部分はMHC分子に結合しているのではなく大きく溶媒中でゆらいでいることがわかった。その分、ペプチド収容溝の中の残基は動かなくてもエントロピーの減少を防げることもわかった。
このようにDXTはミリ秒の動きを計測し、蛍光偏光解消法と分子動力学計算ではナノ秒の動きを観察し、1分子の計算をしたが、すべての方法で短い抗原ペプチドがよく動くということが明らかになった。安定性の低いMHC複合体は、それと反応するT細胞が胸腺で除去される(負の選択)のを免れる。しかしながら、炎症が起こるとT細胞活性化の補助分子がたくさん発現することでそれらの自己反応性のT細胞も活性化される。ペプチド非結合的領域を持つために強く結合するペプチドは胸腺で負の選択を起こし、それらに反応するT細胞は末梢にはほとんど存在しない。今回は、MHC分子と強く結合する長い抗原ペプチドと弱く結合する短い抗原ペプチドの違いは、後者がMHC分子の中でよく動き新たな構造を生み出すことにあるという発見ができた。研究グループは現在、自己反応性のT細胞との反応性を変えずによく動きながら強く結合する変異ペプチドを分子動力学計算で検索し、自己免疫疾患、あるいはそれを逆に癌などの曖昧な自己を標的とした免疫療法として利用することを計画している。
4.発表雑誌:
雑誌名:Biophysical Journal (Cell Pressのジャーナル)
論文タイトル:Single Molecular Motions of MHC Class II Rely on Bound Peptides
著者: Haruo Kozono, Yufuku Matsushita, Naoki Ogawa, Yuko Kozono, Toshihiro Miyabe, Hiroshi Sekiguchi, Kouhei Ichiyanagi, Noriaki Okimoto Makoto Taiji, Osami Kanagawa, and Yuji C Sasaki DOI番号:10.1016/j.bpj.2014.12.004
なお、 この論文は、本号のhighlight論文に選定され、画像等がBiophysical Societyのweb等に掲載されることになった。
3. T細胞の活性化のしくみ
T細胞の活性化は2つの基準で決められています。
1つ目は胸腺における正負の選択です。
正の選択というのは自己のMHCと全く反応できないT細胞クローンは無視されてapoptosisで死んでしまい、反応性を保持したものが生き残る過程のことを云います。TCRはCDR3領域の組換えで多様性を増すのですがその時DNAレベルでは塩基が減ったり増えたりします。もともとTCRはgerm line配列はMHCと少しだけ親和性を持っているのですが、この時フレームシフトや、それ以外の大きな変化が起こってしまうと、それすらも無くしてしまいます。そのようなものは将来的に免疫で役立たないためにいなくなるのです。
負の選択は、自己由来のペプチドを認識するT細胞クローンを除去することです。自分と反応するT細胞は将来的には自己免疫疾患を起こすわけでそのようなものはいらないわけです。胸腺にすべてのタンパク質が機能的に発現しているわけではありませんが、この負の選択を起こすためだけに体中のタンパク質を発現させる仕組み(Aire転写因子等)があるのです。
2つ目は微生物感染したかどうかを示す目印です。2011年のノーベル医学生理学賞は自然免疫の活性化機構の発見に対して与えられました。自然免疫というのは、微生物感染を感知する仕組みの事です。細菌やウィルスは我々の体の成分と明らかに異なる物質を持っています。それらに対して、我々の遺伝子の中にそれらを検知する受容体が備わっています。Toll like receptor(TLR)はその代表的なものです。10種類以上の異なるTLRが見つかっており、様々な微生物由来の物質と結合することが解っています。抗原提示細胞の細胞表面、或いはエンドソームにはTLRが存在し、それらがしかるべきリガンドと結合すると抗原提示細胞は炎症性のサイトカインを分泌したりCD80やCD86というcostimulatory分子を出したりします。T細胞はTCRからの刺激だけでは活性化せず、2次刺激としてcostimulatory分子を必要とします。2時刺激が無い場合、抗原は自己由来である可能性が高いからです。
このように胸腺で大まかに自己に反応するかしないかで篩い分けられ、さらに抹消でも微生物感染した証が必要となります。T細胞の活性化は重要イベントなため2重にチェックされるわけです。
活性化された後は病原体の除去を行うわけですが、その後は速やかに活性化状況を収束させる必要があります。その事に関しては別な項で述べます。
余談ですが、ノーベル賞はBeutlerとHoffmanがそのTLRの発見により獲得しましたが、もっと偉かったのはJanwayです。彼は1989年の論文でTLRは獲得免疫に及ぼす影響について述べています。 私はそのころIL-1の研究をしていました。IL-1の何がすごいかというとマクロファージがLPSを感受すると細胞内にたくさん作るのです。そういうマクロファージとT細胞が会合するとIL-1が細胞外に出てくることが解りました。当時はそのメカニズムを研究していました。今でも完全にそのメカニズムが解明されているわけではありません。IL-1は分泌シグナルを持っていないのです。 でもその時点で何がすごいかというとバクテリアの感染が起こるとIL-1が増えることです。そしてT細胞と反応することによりT細胞のcostimulatory分子であるIL-1が細胞外に出てくることなのです。そうです、現在TLRで当たり前のように言われていることが目の前にあってそれを自分だけが知っているという興奮がありました。残念ながら、レフェリーはことの重要性を解ってくれずnatureをはじめとするトップジャーナルに乗せることはできませんでした。
4. 自己免疫はどうして起こる?
自己免疫を起こさなくする手段として幾つもの機構を生体は備えています。
1つ目は、胸腺での選択です。T細胞の活性化の項に書きましたが自己と反応するT細胞は除去されます。ところがこの負の選択は完璧ではないことがわかっています。自己反応性のT細胞が多数存在するのです。胸腺での正負の選択にも関わらず何故自己反応性のT細胞が残るのか。いくつかの理由があります。
もちろんデメリットは自己と反応することです。しかしながら、利点も考えられます。TCRはVDJ組み換えにより何百万種類ものレパートリーが準備されます。しかし、敵の数はもっと多いことは明白なのです。敵も味方も20種類のアミノ酸からなる10個くらいのペプチドに過ぎません。似通った配列を自分由来のタンパク質と微生物由来のタンパク質がシェアしている可能性は高いのです。負の選択を完璧にしないのは微生物タンパク質と反応する余地を残しておくためでもあります。TCRは特異性が高いと言われていましたが最近ではその概念も変わりつつあります。交差反応性が必須なのです。一つのTCRが10000個のペプチド/MHCに反応する必要があるという計算がされています。それくらい、抗原の量は多いということです。
ではどのようにして、負の選択を免れるT細胞クローンが出てくるのかが問題になります。我々の研究はこの点で自己反応性のT細胞のリガンドとしての構造が如何に形成されるか、明らかにしたものです。
ペプチドが動いて幾つもの構造を取る結果、MHC複合体はType Aの構造も半分程度は取ります。それ故、アルデヒドなどで固定化した細胞にペプチドを加えると、細胞膜上でペプチド交換反応が起こりType BのペプチドMHC複合体が出来ますが、Type AのT細胞も反応することが出来ます。胸腺での負の選択ではType AのT細胞は除去されますから問題になりませんが、Type B T細胞は生き残ります。且つ、Type BのMHC複合体が炎症の場で出来ると自己免疫疾患を起こすのです。Type BのMHC複合体はType B T細胞と反応する構造を半分の時間は取っているからです。要するにType B MHCはType A T細胞もType B T細胞も同等に活性化することが我々の動的構造研究から解ったのです。
2つ目は、danger signalの存在です。TLRはPattern recognition receptorで、pathogen-associated molecular patterns (PAMPs)を認識していることをT細胞の活性化機構の項で述べました。TLRのリガンドが自分の細胞にもあることが解ったのです。それらは、damage-associated molecular patterns (DAMPs)とよばれていて、
<つづく>
5. ガンは免疫でやっつけられる?
 準備中。
準備中。
6.抗原提示経路
 準備中。
準備中。
7. X線1分子追跡法(DXT:Diffracted X-ray Tracking)
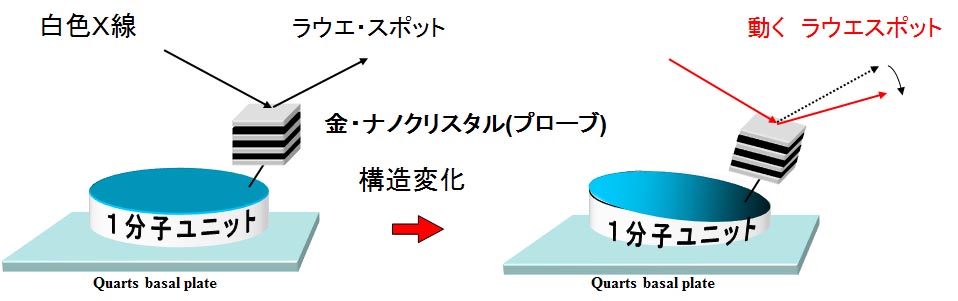 数十ナノメートル程度のナノ結晶をタンパク質に標識し、タンパク質の内部動態に連動したナノ結晶の動きを、ナノ結晶からのX線回折斑点の動きとして高速時分割追跡する手法。佐々木裕次博士が考案し、2000年に発表した。2014年ノーベル化学賞は「超解像顕微法の考案」に貢献した三氏が受賞したが、その基本原理には1分子計測研究の進展が大きく貢献しており、このDXTも「超解像」的な発想を用いた手法で、かつ世界で初めてÅ(オングストローム、1Åは10ナノメートル)レベルの波長を持つ量子ビームでの「超解像法」の実現と定義できる。図は、DXTの原理を示したもの。
数十ナノメートル程度のナノ結晶をタンパク質に標識し、タンパク質の内部動態に連動したナノ結晶の動きを、ナノ結晶からのX線回折斑点の動きとして高速時分割追跡する手法。佐々木裕次博士が考案し、2000年に発表した。2014年ノーベル化学賞は「超解像顕微法の考案」に貢献した三氏が受賞したが、その基本原理には1分子計測研究の進展が大きく貢献しており、このDXTも「超解像」的な発想を用いた手法で、かつ世界で初めてÅ(オングストローム、1Åは10ナノメートル)レベルの波長を持つ量子ビームでの「超解像法」の実現と定義できる。図は、DXTの原理を示したもの。
7. 蛍光寿命測定法
 偏光励起光を蛍光物質に照射することにより、蛍光物質から発せられる蛍光が分子の回転する速度に応じて異なった偏光度を示すという測定方法。蛍光分子により標識された分子の回転速度が速いと偏光が解消され、偏光度は小さい値を示す。反対に分子の回転速度が遅いと蛍光の偏光は解消せず偏光度は大きな値を示す。
偏光励起光を蛍光物質に照射することにより、蛍光物質から発せられる蛍光が分子の回転する速度に応じて異なった偏光度を示すという測定方法。蛍光分子により標識された分子の回転速度が速いと偏光が解消され、偏光度は小さい値を示す。反対に分子の回転速度が遅いと蛍光の偏光は解消せず偏光度は大きな値を示す。
