- 1.生命における認識機構の解明
- 2.自己免疫疾患発症の解析と治療に向けた試み
- 3.TCRとペプチド/MHC複合体の相互作用の研究
- 4.MHCのペプチド獲得機構
- 5.ペプチド依存性のMHCの品質管理機構
研究内容のご紹介
1. 生命における認識機構の解明
生命活動はタンパク質がいろいろな物質を認識し相互作用を行うことで成り立っています。細胞内ではそのような相互作用が複雑なネットワークとなって、様々な帰結としての行動を引き起こします。また、細胞表面の受容体は其のリガンドが結合することによって細胞内部にシグナルを送り込みます。免疫細胞には様々な受容体がありますが、T細胞受容体(TCR)は特殊なものです。例えば、サイトカイン受容体の場合、そのサイトカインが結合すると即座にシグナルが内部に伝達されます。しかしながら、TCRの場合、受容体自体が結合したものがその受容体のリガンドであるのかどうかを判断しなければならないのです。何故なら、結合したリガンドが未知の物だからです。私たちの研究室では、TCRが何を基準にして結合状態として判断するのか研究しています。実はこのことは他のタンパク質間の相互作用でもあることなのですが、長い進化の過程で決まってしまい遺伝子に組み込まれています。遺伝子に組み込まれた相互作用の関係性を解く事は、多くの生物学研究の課題でもあります。それ故、免疫応答における相互作用は、悠久の進化の過程を1個体の中での検証できるモデルと為り得るのです。
2. 自己免疫疾患発症の解析と治療に向けた試み
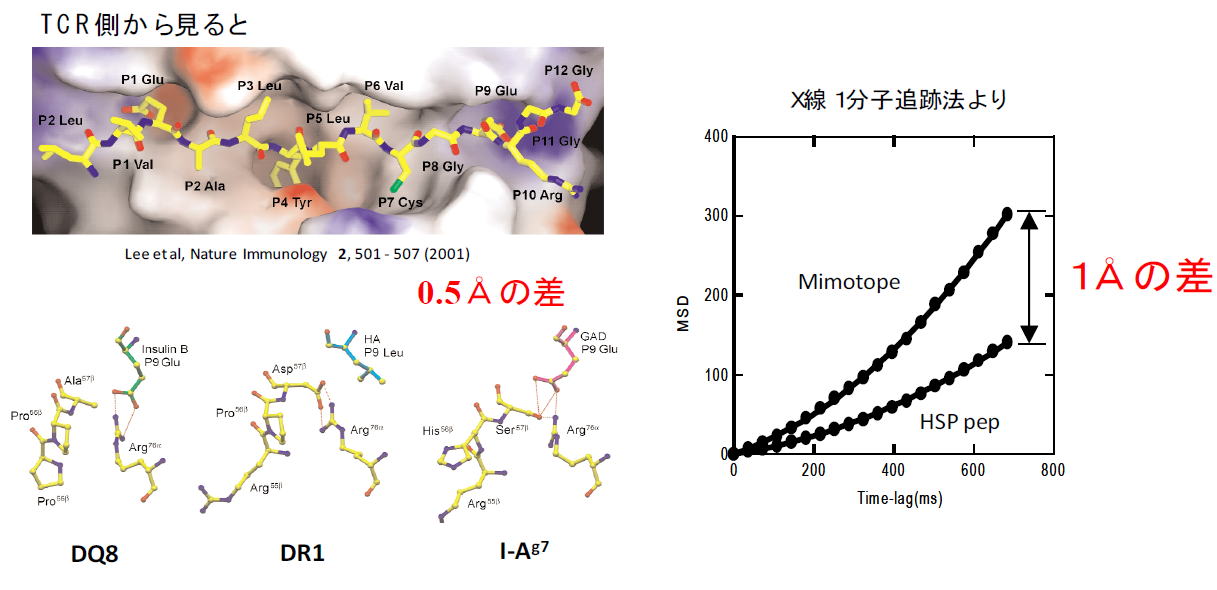 免疫学に於ける、大まかな基本的応答の仕組みは、解明されつつありますが、その臨床応用はまだチャレンジングな課題として残されています。
その中のMHC依存的自己免疫疾患の解明と臨床への応用を追及したいと考えています。1型糖尿病(T1D)を引き起こす要因は、遺伝的に雑多ですが、MHCの関与は最も大きいと考えられています。
人及びマウスにおいてT1Dの原因となるMHC遺伝子座は同定されています。それらに共通する特徴は、b鎖の57番目の残基がAsp以外のアミノ酸Ser、Ala等の中性残基に置き換わっているということです。
マウスIDDM の原因MHCであるI-Ag7のX線結晶解析がなされた結果、p9ポケットの入り口が、やや広がっていることがわかりましたが、それ以外はペプチドの構造を含め、他のI-A分子とほとんど変わっていません。この構造的特長から類推されることはペプチドがI-Ag7と緩く結合するということです。緩く結合するとどうして自己免疫と繋がるのでしょうか。それは、ペプチドとI-Ag7複合体の安定性にあると考えられます。自己のペプチドなのに胸腺で負の選択を起こせるほど強く結合できないのでは無いかと考えられます。そのため、自己を認識するT細胞が抹消に多数存在するようになることが予測されます。
免疫学に於ける、大まかな基本的応答の仕組みは、解明されつつありますが、その臨床応用はまだチャレンジングな課題として残されています。
その中のMHC依存的自己免疫疾患の解明と臨床への応用を追及したいと考えています。1型糖尿病(T1D)を引き起こす要因は、遺伝的に雑多ですが、MHCの関与は最も大きいと考えられています。
人及びマウスにおいてT1Dの原因となるMHC遺伝子座は同定されています。それらに共通する特徴は、b鎖の57番目の残基がAsp以外のアミノ酸Ser、Ala等の中性残基に置き換わっているということです。
マウスIDDM の原因MHCであるI-Ag7のX線結晶解析がなされた結果、p9ポケットの入り口が、やや広がっていることがわかりましたが、それ以外はペプチドの構造を含め、他のI-A分子とほとんど変わっていません。この構造的特長から類推されることはペプチドがI-Ag7と緩く結合するということです。緩く結合するとどうして自己免疫と繋がるのでしょうか。それは、ペプチドとI-Ag7複合体の安定性にあると考えられます。自己のペプチドなのに胸腺で負の選択を起こせるほど強く結合できないのでは無いかと考えられます。そのため、自己を認識するT細胞が抹消に多数存在するようになることが予測されます。
最近ではI-Ag7以外のMHCも自己免疫疾患に関わることが判ってきました。I-Ag7で判ったことはペプチド収容溝が少し開いていてペプチドの動きに自由度があることでは無いかという事でした。似たようなことが通常のMHCでも有ることが判ったのです。最近まで、1つのペプチドはclass II MHCの場合タンパク質としての折りたたみの一部となり非常に硬い構造を取ることが予測されていました。ところが、1つのペプチドとMHCが幾つもの構造を取ることが判ってきたのです。さらに、それにはDMの触媒も関係してきます。DMが触媒して出来たペプチド/MHC複合体とDMなしでできたペプチド/MHC複合体は構造が違うらしいのです。我々は、どのような構造が生まれるのか、DMはいったい何をしているのか、既存のMHC/ペプチド複合体を自己免疫性のものからそうでないものに変えるにはどうしたらいいのか、解析を行っています。
3. TCRとペプチド/MHC複合体の相互作用の研究
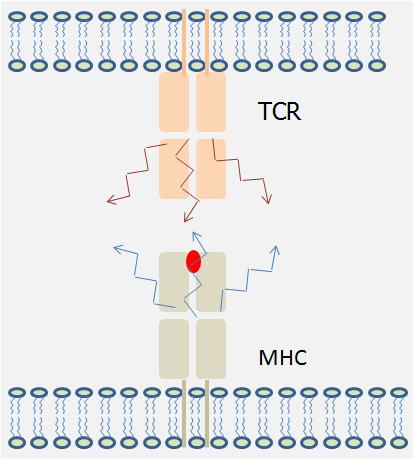 MHC分子は、様々な種類のペプチドを獲得し、T細胞に抗原提示を行います。それらのMHC/ペプチドの安定性は様々であることが想定されます。
また、近年、種々のTCRのアフィニティが測定された結果、必ずしもアフィニティ、及び、オフレートとT細胞の活性化が一致していないことが明らかとなってきました。すなわち、もちろんある程度のアフィニティは重要であるけど、T細胞応答の大きさにはあまり重要でないかもしれない。とにかく、何らかの形で結合し、まわりに炎症反応を惹起するシグナルが存在すればそこでT細胞は活性化してしまうということです。周りの炎症反応とはTLR等に結合するバクテリアやウイルス或いは自己のDNA成分などの存在です。我々はMHC/ペプチドの分子運動性に注目しています。分子内運動によって新たな構造が生み出され、TCRと結合できるようになる可能性が出てきました。
MHC分子は、様々な種類のペプチドを獲得し、T細胞に抗原提示を行います。それらのMHC/ペプチドの安定性は様々であることが想定されます。
また、近年、種々のTCRのアフィニティが測定された結果、必ずしもアフィニティ、及び、オフレートとT細胞の活性化が一致していないことが明らかとなってきました。すなわち、もちろんある程度のアフィニティは重要であるけど、T細胞応答の大きさにはあまり重要でないかもしれない。とにかく、何らかの形で結合し、まわりに炎症反応を惹起するシグナルが存在すればそこでT細胞は活性化してしまうということです。周りの炎症反応とはTLR等に結合するバクテリアやウイルス或いは自己のDNA成分などの存在です。我々はMHC/ペプチドの分子運動性に注目しています。分子内運動によって新たな構造が生み出され、TCRと結合できるようになる可能性が出てきました。
4. MHCのペプチド獲得機構
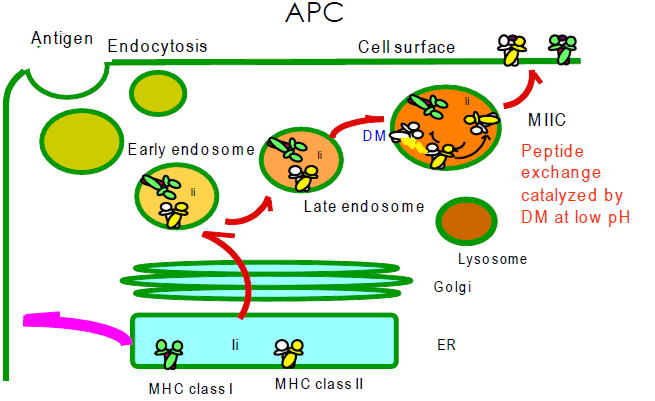 組織適合性抗原(MHC)は、細胞内部の抗原をT細胞受容体(TCR)に提示するという、免疫系に於いて、最も重要な役割をもつタンパク質の一つです。
抗原提示細胞(APC)は、まず細胞外の抗原をphagocytosisやB細胞抗原受容体(BCR)を介したendocytosisによって細胞内にendosomeとして取り込みます。
このendosomeは、MIICやCIIVと呼ばれる、lysosome様の小胞と融合します。これらの小胞の内部pHは4.5~5.5の間であることが特徴です。
また、カテプシン類をはじめとする種々のタンパク質分解酵素を保有しており、故に外来のタンパク質はペプチド断片に変化していきます。
一方、MHC class II(MHC II)は、小胞体(ER)で生合成された後、近傍で生合成されたインバリアント鎖(Ii)と結合する。Iiの一部は、MHC IIのペプチド収容溝に結合し、ERに存在するMHC Iを標的とするペプチドとの結合を防ぎます。
Endosomeに到達した直後のMHC IIはIiと結合しているが、カテプシンにより分解されます。しかしながら、ペプチド収容溝にはCLIPというIi由来のペプチドが残ります。
CLIPは、酸性pHとDMという分子による触媒作用で外来性のペプチドと交換されます。DMが存在しないと免疫応答に支障が出ることが判っています。抗原提示がされなくなるのです。DMの触媒機構がどのようなものであるかはまだ判っていませんが、我々は触媒反応の中間状態を検出することに成功しています。また、酸性pHのペプチド交換に於ける役割に注目しています。結晶解析はpH5~pH8.5の間でなされていますが、その構造に違いは見出せません。
どのような構造的特徴が、ペプチド交換を可能にするのか、DMと酸性pHの役割を生化学的、物理化学的手法により明らかにしようとしています。
組織適合性抗原(MHC)は、細胞内部の抗原をT細胞受容体(TCR)に提示するという、免疫系に於いて、最も重要な役割をもつタンパク質の一つです。
抗原提示細胞(APC)は、まず細胞外の抗原をphagocytosisやB細胞抗原受容体(BCR)を介したendocytosisによって細胞内にendosomeとして取り込みます。
このendosomeは、MIICやCIIVと呼ばれる、lysosome様の小胞と融合します。これらの小胞の内部pHは4.5~5.5の間であることが特徴です。
また、カテプシン類をはじめとする種々のタンパク質分解酵素を保有しており、故に外来のタンパク質はペプチド断片に変化していきます。
一方、MHC class II(MHC II)は、小胞体(ER)で生合成された後、近傍で生合成されたインバリアント鎖(Ii)と結合する。Iiの一部は、MHC IIのペプチド収容溝に結合し、ERに存在するMHC Iを標的とするペプチドとの結合を防ぎます。
Endosomeに到達した直後のMHC IIはIiと結合しているが、カテプシンにより分解されます。しかしながら、ペプチド収容溝にはCLIPというIi由来のペプチドが残ります。
CLIPは、酸性pHとDMという分子による触媒作用で外来性のペプチドと交換されます。DMが存在しないと免疫応答に支障が出ることが判っています。抗原提示がされなくなるのです。DMの触媒機構がどのようなものであるかはまだ判っていませんが、我々は触媒反応の中間状態を検出することに成功しています。また、酸性pHのペプチド交換に於ける役割に注目しています。結晶解析はpH5~pH8.5の間でなされていますが、その構造に違いは見出せません。
どのような構造的特徴が、ペプチド交換を可能にするのか、DMと酸性pHの役割を生化学的、物理化学的手法により明らかにしようとしています。
5. ペプチド依存性のMHCの品質管理機構
MHCはその結合したペプチドにより細胞表面での半減期が異なることが知られています。また、MARCH Iと呼ばれるユビキチンリガーゼは発達分化段階での抗原提示細胞上の全体量を制御することが知られています。そこでペプチド依存的にMHCが細胞表面から消失するのは揺らぎを基準としたユビキチン化がされるからではないかと考え、MARCH I KOマウス骨髄細胞からDCを誘導しMHC IIの半減期を調べています。その結果、MARCH Iによるユビキチン化はペプチドの選択を制御することが示唆されています。MARCH IはMHCだけでなくDMなどの関係分子をユビキチン化することも知られているため、その影響を調べています。またこの品質管理機構がうまく働けば自己免疫性のMHCを減少させることが出来ると考えられるため、そのメカニズムの詳細な解析の検討をしています。
