1.
B細胞初期分化の制御機構
2.
多様な反応を誘導するB細胞抗原受容体シグナル経路の解明
4.
MARVELドメインをもつ膜蛋白ファミリー分子の機能解析
B細胞初期分化の鍵であるプレB細胞受容体のシグナル伝達機構を解明し、それによってプレB細胞に引き起こされる様々なイベントがいったいどうやって誘導され制御されているのかを明らかにします。
お暇ならこちらも -> 「抗原を認識する、故にB細胞在り」
2. 多様な反応を誘導するB細胞抗原受容体シグナル経路の解明
抗原受容体(BCR)が抗原に出会うと、B細胞は抗体産生細胞か記憶細胞に分化して免疫応答に活躍します。ここでも、細胞の活性化、様々な蛋白の発現、細胞増殖あるいはアポトーシス、そして分化方向の決定と、様々なイベントが起こります。一方、生まれたばかりのB細胞が抗原と出会うと、これを自己抗原と見なして、B細胞は不活性化されたり(anergy)、BCRを交換したり(receptor
editing)します。こうして自己反応性のB細胞があらかじめ除かれることは免疫系の自己寛容の成立に重要です。このように様々な細胞の反応がどうやって同じBCRから惹起されるのでしょうか。私達は、BCRシグナル経路が途中で多岐に別れ、それぞれがうまくコントロールされることによって、異なる様々の反応を導くと考えています。この複雑なシグナル伝達の仕組みを解き明かしたいと思っています。現在、特にアダプター分子BASHを中心においてシグナルを考えています。BASH(別名BLNK/SLP-65)はB細胞特異的に発現するアダプター蛋白で、BCRが抗原に刺激されるとチロシンリン酸化され、様々な分子と結合し、下流へとシグナルを伝えます。これまでに、BASHがBtkおよびPLCg2と結合することにより、PLCg2のリン酸化および活性化を仲介すること、VavおよびGrb2と結合しVavによるRac1の活性化を促進すること、NF-ATやNF-kBなどの転写因子の活性化に必要であることが明らかになっています。T細胞その他の造血系細胞に発現するSLP-76、マスト細胞と活性化T細胞に発現するMIST(別名Clnk)とは構造や機能が良く似ていて、ひとつのアダプター分子ファミリーを形成しています。
In vivoのアプローチとしては、BASHのノックアウトマウスを色々な方法で解析して、抗体産生や記憶形成、B細胞性自己寛容にどういう異常が現れるかを調べます。これまでにわかったことは、BASHノックアウトマウスでは、成熟B細胞と腹腔のB-1細胞が著しく減少し、残ったB細胞は死にやすく、抗原受容体を刺激してもほとんど活性化も増殖もしません。マウスの血清中の抗体価は正常の1/10かそれ以下で、T細胞非依存性抗原で免疫した場合はそれに対する抗体をほとんど産生しません。しかし、蛋白などT細胞依存性抗原に対してはIgMクラス以外は正常に抗体を産生しました。これらのことから、B細胞の成熟、活性化、増殖を誘導する抗原受容体からのシグナル伝達にBASHが重要な役割を果たしていることが明らかになりました。最近、抗原受容体のもうひとつの重要な働きである自己トレランスの誘導、すなわち、receptor editing1)がBASHノックアウトマウスではうまく起こっていないことがわかりました。
BASHノックアウトマウスを胸腺非依存性抗原(T細胞を必要としない多価抗原)で免疫してもそれに対する抗体を産生しません。一方、胸腺依存性抗原(T細胞を必要とする蛋白質抗原)を免疫するとIgM型抗体はほとんど産生しませんが、IgG型抗体は正常と比べると随分遅れますが、ある程度産生します。さらに追加免疫をしますと、今度は正常マウス以上にIgG型の抗原特異的抗体を産生します。この抗体には正常に体細胞突然変異が入っており、抗原に対する親和性は十分に高くなっています。すなわち、最初は抗原に反応するB細胞クローンの増殖が遅くその数が少ないのですが、ゆっくりと増えていって、2度目の免疫には正常な応答ができるようになるということです。ここから、T細胞ヘルプを必要とするクラススイッチ、体細胞突然変異、高親和性クローンの選択、記憶形成などの過程にBASHを介したシグナル経路は必要ではないということが分かります。面白いことに、BASHノックアウトマウスの半数程度では、抗原特異的IgGの産生が免疫後1年たってもずっと高いままで、骨髄には抗体産生細胞(長期生存プラズマ細胞)が異常に多く存在しています。また、3度目の免疫をすると、正常マウスよりも高い抗原特異的IgGを産生します。すなわち、抗原特異的記憶B細胞の数が多い(あるいはクローン増殖が大きい)と考えられます。このことから、一度抗原に応答したB細胞では、次のBCR刺激による細胞増殖・分化においてBASHはむしろBCRシグナル伝達に抑制的に働くと考えられます。これはB細胞の活性化によるBCRシグナル伝達経路の変換を意味するのか、あるいは、IgM型BCRとIgG型BCRのシグナル伝達経路の違いによるものか、そしてBASHがそこにどう関わるのか、これらのことを明らかにするために現在研究を続けています。
脾臓やリンパ節において抗原に反応したB細胞が増殖し胚中心と呼ばれる構造を形成します。この胚中心において高親和性のB細胞クローンが選択され、その中から記憶B細胞や長期生存プラズマ細胞が分化していきますが、そのような選択や分化のメカニズムはほとんど分かっていません。これを明らかにしていくために、B細胞を胚中心様の細胞として増殖させる培養系を作製しました。この系を用いて、今後は、体細胞突然変異の誘導シグナル、高親和性クローンの選択や分化方向の決定のメカニズムを明らかにして行きたいと思っています。
In vitroのアプローチとしては、BASH欠損B細胞を生化学的に解析し、シグナル伝達におけるBASHの役割、作用機序を明らかにします。また、BASHと結合する蛋白を同定してその役割を調べています。まず、Ste20ファミリーに属するMAP-KKKKであるHPK1が、チロシンリン酸化された後BASHのSH2ドメインに結合して活性化することを見出しました。HPK1はMAPKやNF-kBの活性化に関与すると言われていますが、B細胞ではBCRシグナルによるNF-kBの活性化を促進することがわかりました。さらにYeast two hybrid法を用いて、新規のBASH結合蛋白(BNAS1, BNAS2)を同定しました。これらの機能を明らかにし、新しい抗原受容体シグナル経路を見つけたいと思います。
注1)自己抗原と結合して強いシグナルを受けたB細胞はすでに完成しているL鎖遺伝子領域に再びV-J再構成を起こし、新しいL鎖遺伝子を作るとことができます。こうして抗原受容体の特異性を自己に反応するものから別のものに変更することをreceptor editingと呼びます。
プレB細胞性急性リンパ性白血病(pre-B ALL)は小児のがんの中で発症率が最も高い病気です。現在では化学療法など治療法の進歩により寛解率は向上していますが、未だ完全治癒は容易ではありません。また、化学療法の副作用が患者に大変な苦痛を与えることも問題であり、白血病細胞特異的に作用する新たな治療法が待たれています。pre-B ALLにはE2A-PBX、TEL/AML1あるいはBCR-ABLといった染色体転座が見出されることがありますが、多くはまだ原因が不明です。この白血病の発がんの原因を明らかにすることは、その標的治療の開発にとって不可欠であります。
上記のように、B細胞特異的アダプター蛋白 BASH(SLP-65/BLNK)は種々のシグナル因子と結合し、BCRシグナルによるカルシウム動員やMAPキナーゼ、NF-kB等の活性化、B細胞の生存・増殖に必要です。BASH ノックアウト(KO)マウスではB細胞分化抑制が起こり、骨髄には普通では見られないプレB細胞受容体(preBCR)陽性の大型プレB細胞の蓄積がみられます。しかし、この細胞の細胞周期はG0/G1期で抑制されています。また、BCRの副受容体CD19とのダブルノックアウト(DKO)マウスではプレB細胞分化・増殖が完全に停止しました。したがって、部分的にCD19に代償されうるものの、BASHはプレB細胞の増殖と分化を誘導するpreBCRシグナル伝達に必要であることが明らかになりました。驚いたことに、BASH-KOマウスの約5%、BASH/CD19-DKOマウスの約15%に、生後4週以内にpre-B ALLが発症しました。この白血病細胞は単クローン性で、転移性が高く、発症した個体は全部死亡しました(Hayashi et al., Immunity 2003)。ヒトにおいても、小児pre-B
ALLの約半数例で白血病細胞内のBASHの発現が消失していることが報告されています(Jumaa et al., Nature 2003)。したがって、BASHはプレB細胞の癌化を抑制する癌抑制因子と考えられます。さらに、BASHとBtkとの二重欠損マウスではプレB細胞分化の完全停止に加え、プレB細胞白血病の発症率が大幅に増加します(Kersseboom et al., JEM
2003)。CD19, SLP-76, Btkそれぞれ単独欠損マウスではプレB細胞分化抑制も白血病も起こらないので、これらはBASH欠損下で部分的にBASHの癌抑制機能を代償していると考えられます。
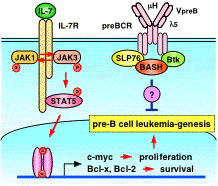 PreBCRを構成するmH鎖やl5の欠損では白血病は発症しないので、BASHを介する特異的シグナルがプレB細胞の癌化を抑制していると考えられます。また、発症率から考えてBASH欠損に加えて多段階の遺伝子異常の蓄積が癌化に必要であると思われます。私たちはこのBASH欠損マウスをモデルとして、また、発症したマウスから樹立したプレB白血病細胞を用いて、癌化抑制を伝えるBASH下流のシグナル経路を明らかにし、また、BASH欠損に共役して癌化を促進している遺伝情報異常を同定し、これらの知見をもとにpre-B ALLの発生原因を明らかにしたいと思っています。現在までに、IL-7受容体-STAT5経路がこの白血病の発生に強く関わっていることを明らかにしています。この研究の成果は、プレB細胞の白血病化の分子機構を明らかにすると同時に、preBCRシグナル系を標的とした副作用の少ない治療法の開発に貢献すると期待されます。
PreBCRを構成するmH鎖やl5の欠損では白血病は発症しないので、BASHを介する特異的シグナルがプレB細胞の癌化を抑制していると考えられます。また、発症率から考えてBASH欠損に加えて多段階の遺伝子異常の蓄積が癌化に必要であると思われます。私たちはこのBASH欠損マウスをモデルとして、また、発症したマウスから樹立したプレB白血病細胞を用いて、癌化抑制を伝えるBASH下流のシグナル経路を明らかにし、また、BASH欠損に共役して癌化を促進している遺伝情報異常を同定し、これらの知見をもとにpre-B ALLの発生原因を明らかにしたいと思っています。現在までに、IL-7受容体-STAT5経路がこの白血病の発生に強く関わっていることを明らかにしています。この研究の成果は、プレB細胞の白血病化の分子機構を明らかにすると同時に、preBCRシグナル系を標的とした副作用の少ない治療法の開発に貢献すると期待されます。
4. MARVELドメインをもつ膜蛋白ファミリー分子の機能解析
リンパ球B細胞上の抗原受容体(BCR)は抗原と結合した時、主に2つの役割を果たす。1つは細胞の活性化・増殖・分化等を誘導するシグナルを細胞内へ発信することで、もう1つは抗原の分解と提示のために抗原をエンドサイトーシスによって細胞内へと取り込む(インターナリゼーション)ことである。細胞内シグナル伝達では、まずチロシンキナーゼの活性化によって種々のシグナル伝達因子がリン酸化され、互いに結合して細胞膜下にシグナロソームと呼ばれる複合体を形成する。ここで活性化したフォスフォリパーゼ(PLCg2)、PKC、PI3キナーゼなどの酵素がさらに複数のシグナルカスケードを活性化することは生化学的にはかなり明らかになっている。しかし、これらのカスケードの最後に活性化された例えばMAPキナーゼや転写因子などがどのように細胞膜下から核まで輸送されるかについてはほとんど分かっていない。また同様に、どうやってアポトーシスあるいは生存のシグナルがミトコンドリアへ、翻訳促進シグナルが小胞体へと伝えられるかも不明である。一方、インターナリゼーションされた抗原は初期エンドソームを経由して、新生MHC-classIIに富むエンドリソソームコンパートメント(MIIC)に運ばれ、分解されペプチドとなり、MHC上に提示される。この過程は、細胞内シグナル伝達と同様、抗原受容体IgaサブユニットおよびチロシンキナーゼSykを必要とするが、インターナリゼーションされた抗原―受容体複合体の細胞内輸送のメカニズムはよく分かっていない。これらの研究の進展には、細胞内蛋白輸送に関与する新たな分子の同定とその機能解明が必要である。
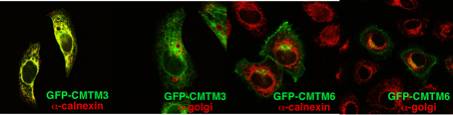
われわれはBCRシグナル伝達に関与するアダプター分子 BASH(SLP-65/BLNK)を同定し、その機能について研究してきた。BCR架橋によりBASHは種々のシグナル因子と結合し、細胞内カルシウム上昇、MAPキナーゼやNF-kBの活性化、細胞の活性化・増殖に必要である。BASH欠損マウスではプレB細胞期に分化の停滞が起こり、またB細胞の成熟も低下する。このマウスの骨髄にはプレB細胞受容体(preBCR)陽性の細胞が蓄積していることから、BASHはpreBCRからの分化促進シグナルだけでなく、preBCRのインターナリゼーションにも必要であると思われた。BASHの作用機序を理解するために、種間で保存されているN末端の塩基性ドメインをbaitとして、2ハイブリッド法によりBASHと結合する蛋白を同定した。その1つ(BNAS2と命名)は4回膜貫通ドメインを内包するMARVELドメインを有し、主に小胞体、核膜、および一部は細胞膜に存在する。BNAS2の機能を探るために、ニワトリB細胞株DT40のBNAS2欠損株を作製し、現在これを解析している。一方、データベースによる相同性検索より、BNAS2と同じくMARVELドメインを含む分子群を同定した(CMTM1~8と命名)。これらは相互に弱い相同性を示し、そのほとんどは2つの遺伝子領域にクラスターを成し、遺伝子ファミリーを形成していた。これらは細胞質内の小胞体、核膜、ゴルジ体、TGNあるいは細胞膜に局在していた。今後、これらの膜蛋白の機能を解明したい。