![]() 研究内容
研究内容
B細胞は造血幹細胞から発生し、プロB細胞、プレB細胞を経て、B細胞へと分化します。ヒトやマウスなど多くの動物では、胎児期には主に肝臓で、生後は主に骨髄でこのB細胞初期分化が起こります。B細胞の初期分化で最も特徴的なことは抗体(免疫グロブリン:Ig)遺伝子の再構成が起こることです。まず、H鎖遺伝子領域にある多数のV, D, Jの遺伝子断片からそれぞれ1つずつがランダムに選ばれてDNA組み換えにより結合し、VDJというひとつのエクソンを形成します。この過程はプロB細胞で起こり、この再構成に成功したH鎖遺伝子からはmH鎖蛋白が作られます。そこでmH鎖蛋白はそれ以前に発現していたVpreBおよびl5というふたつの蛋白とともに複合体(プレB細胞受容体:pre-B cell receptor, preBCR)を形成します。VpreBとl5はあわせてL鎖様の構造をもっているので代替L鎖(surrogate light chain)とも呼ばれますが、B細胞以降の分化段階では発現していません。preBCRが細胞膜上に発現すると細胞分裂が起こり、RAG活性の低下によりH鎖再構成が止まり、細胞数が増えます。この段階の細胞を大型プレB細胞と呼びます。実際にはほとんどの大型プレB細胞はpreBCR陰性です。これはpreBCRが細胞表面に発現している時間が非常に短いためと考えられています。数回の細胞分裂の後、分裂は停止し、細胞は小型プレB細胞となります。この細胞ではL鎖(k
/ l)遺伝子のV-J再構成が起こります。これに成功した遺伝子から作られるL鎖蛋白はmH鎖と一緒にIgMを形成して、細胞膜上に発現します。ここでついにIgMという抗原受容体を持ったB細胞が誕生します1)。次ぎにB細胞はこのIgMと同じ抗原特異性を持つIgDをも発現し、骨髄から末梢リンパ組織へと移行します。末梢ではさらに、IgMよりIgDの発現が高い成熟B細胞へと分化します。
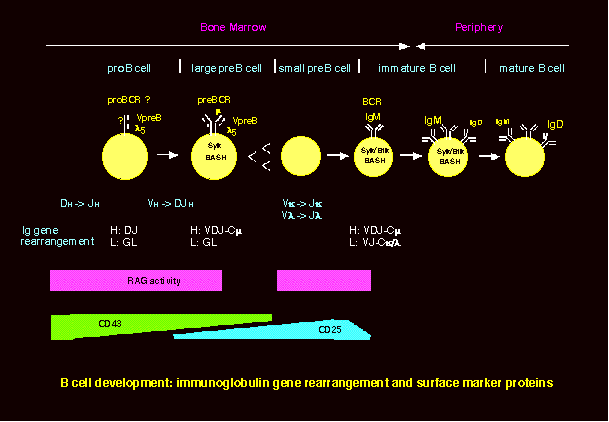
preBCRを細胞表面に発現している細胞は非常に少ないのですが、膜型m鎖変異マウスではB細胞分化がプレB細胞の手前で停止しているので、やはり細胞膜上にpreBCRが発現して細胞内にシグナルを送ることが重要だと考えられます。preBCRを構成する膜型m鎖、l5、VpreBのそれぞれのノックアウトマウスの解析から、preBCRには以下のような機能があることが明らかになっています2)。
1) プレB細胞の分裂・増殖
2) 大型プレB細胞から小型プレB細胞への分化
3) IgH鎖遺伝子再構成の抑制(対立遺伝子排除)
これらの機能は生理的に大きな意義があると考えられています。まず、1)は機能的なH鎖蛋白ができたことをチェックし、その機能的な細胞を選択的に増加させるのに役立っています。DNA組み換えによるIg遺伝子再構成は成功より失敗の方がはるかに多いプロセスですから、限られたスペースの中で成功した有意義な細胞を選択することは重要です。2)分化が進行することが重要なのはいうまでもありませんが、ここでは分裂が停止して小型プレB細胞へ分化し、RAG(再構成に必須の酵素)の活性が再上昇し、L鎖遺伝子の再構成が開始されることも重要です。もし、H鎖とL鎖の遺伝子が同時期に再構成すると失敗の確率は相乗的に高くなるはずですから、すでに機能的H鎖を有する細胞においてL鎖遺伝子再構成が開始されることが効率を高めるのに重要だと思われます。3)は一方のIgH鎖対立遺伝子(アレル)がV-DJ結合に成功し機能的なmH鎖を発現するともう一方のアレルの再構成を抑制するというもので、B細胞の「1細胞―1特異性」の原則を確立するのに重要な機構です。いま、DJ結合まで進んだIg遺伝子の2つの対立遺伝子(アレル)が互いに勝手にV-DJ再構成できるとすると、ごく単純に考えて1/9の確率で両方のアレルが機能的なH鎖遺伝子を作ってしまいます(VとDJのコドンの読み枠が一致する確率は1/3だから)。一方、両方のアレルがともに非機能的なH鎖遺伝子を作る確率は4/9(2/3 × 2/3)で、このような細胞は抗原受容体を発現しないのでB細胞にはなれません。したがって、産生されるB細胞のうち2つの機能的なH鎖遺伝子をもつ細胞は1/9 ÷ 5/9)で、1/5となります。すなわち、対立遺伝子排除の機構がなければ、20%のB細胞のそれぞれが2つの異なるH鎖を発現してしまい、2つの抗原特異性を持つことになります。これらの細胞がある抗原に出会ってそれに対する抗体を産生するようになると、もうひとつの無関係の特異性を持つ抗体も産生されてしまいます。この後者の抗体が自己抗原に反応しないという保証はないのです。
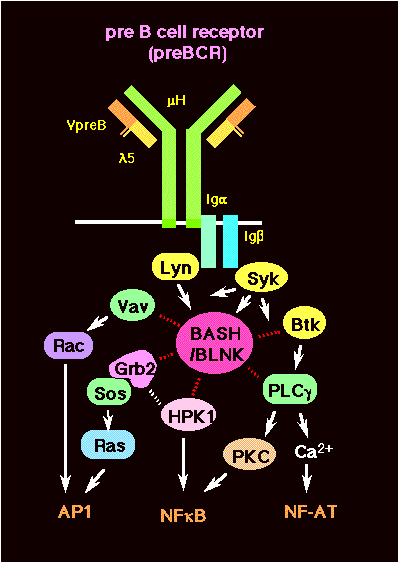
このように重要な機能を担うpreBCRですが、そのシグナル伝達機構はまだ十分に理解されていません。私たちはこれら3つの異なる機能がどのようにして引き起こされるのか、それがpreBCRからどのようなシグナル経路で伝達されるのかということを、分子レベルで明らかにしたいと考えています。これまでの研究から、preBCRのシグナル伝達に関わるシグナル因子のほとんどは抗原受容体(BCR)シグナルのものと共通だと考えられています。しかし、それらのノックアウトマウスはBCRシグナルによるB細胞の活性化異常を示すものがほとんどで、プレB細胞の手前で分化停止を示したのはSykノックアウトマウスだけです。Sykはシグナル伝達の起点ともいうべきチロシンキナーゼで種々のシグナル因子をリン酸化しますが、そのうちどの因子がどの経路に働いているのだろうかというのが私たちの疑問です。私たちが作製したBASH(別名BLNK/SLP-65;詳細は下記参照)の欠損マウスではB細胞初期分化が不完全で、少数のB細胞は存在するものの、骨髄では小型プレB細胞が消失し、代わりに大型プレB細胞が蓄積していました。おもしろいことに、この大型プレB細胞は通常見られないpreBCR陽性の細胞で、しかも細胞回転がほとんど停止していました。したがって、分化誘導に必要なpreBCRのシグナル伝達にはBASHが関わっており、preBCRを発現してもBASHがないと細胞分裂がうまく誘導できず、その段階で分化が停滞してしまったと考えられます。また、preBCRの細胞表面からの素早い消失にもBASHを介したpreBCRシグナルが関与している可能性も示唆されます。しかしながら、H鎖対立遺伝子排除は骨髄でも末梢でも正常であり、2種類のH鎖を発現しているプレB細胞やB細胞はありませんでした。このことから、シグナル経路はすでにBASHのところで少なくとも2つに分岐していることが明らかとなりました。プレB細胞の分裂を誘導するシグナルはBASHからどう伝わっていくのか、その最初の標的遺伝子は何か、また、この細胞分裂の停止、小型プレB細胞への分化、L鎖遺伝子再構成開始という過程はどのように誘導されるのかなど、これから解明すべきことはまだ沢山あります。さらに、H鎖対立遺伝子排除すなわちpreBCRシグナルによってH鎖再構成が抑制される機構はまったく分かっていません。このBASHを介さないシグナル経路にも大変興味が持たれます。
注
1)再構成に成功したひとつの免疫グロブリンH鎖遺伝子から転写されたRNA(VDJ-Cm)から異なるスプライシングにより2種類のmRNAができ、そこから膜型mH鎖と分泌型mH鎖とが翻訳されます。前者がL鎖と結合したものが抗原受容体で、後者がL鎖と結合したものが抗体です。B細胞が抗原と出会うまでは前者のmRNAがほとんどで、抗原受容体(膜型IgM)が細胞表面に発現していますが、抗原刺激を受けるとスプライシングのパターンが変化し、後者のmRNAが急増して、分泌型のIgM抗体が大量に産生されるようになります。また、IgDのH鎖であるd鎖も同じH鎖遺伝子から産生されますが、mH鎖mRNAがVDJとCm遺伝子とのスプライシングによるのに対し、d鎖mRNAはVDJとCd遺伝子とのスプライシングにより作られます。 (topへ戻る)
2) これら以外に、preBCRシグナルによってIgL鎖遺伝子再構成が誘導されるという報告もありますが、preBCRノックアウトマウスではL鎖遺伝子再構成はなくならないので、preBCRシグナルがこの再構成に必須ではないようです。(topへ戻る)
お暇ならこちらも -> 「抗原を認識する、故にB細胞在り」