生命科学研究所の目標
生命超(スーパー)システムの統合的理解
高等生物の発生、行動、ホメオスタシス、感染防御など極めて複雑な高次機能のメカニズムの理解は、これまでの一次元的反応系の解析のみでは不可能であり、新たな理論・概念を必要としている。本研究所では、とりわけ解析の進んでいる免疫系を軸として、高等生物を超(スーパー)システム−内外の情報に適応しながら自立的に進化し自己組織化する多階層システム−と捉え、その理論的基盤を確立するための研究を進めている。今後もこれを強力に推進し、さらに病気の発生と治癒、組織再生、免疫応答などのシミュレーション、創薬応用へと発展させたい。また、生命科学研究科を拠点として、それを担う創造的人材を育成する。
研究内容
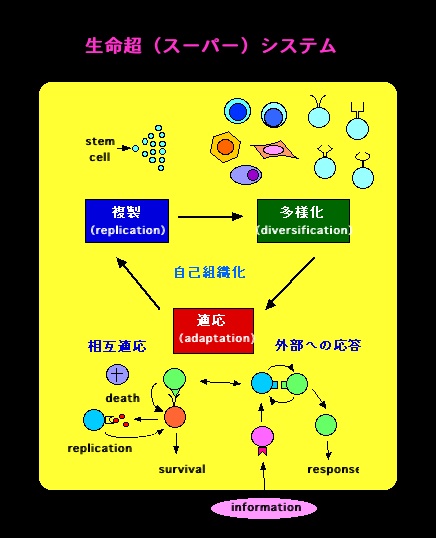
高等生物の生命活動のメカニズムを統合的に理解するためには、生命体を分子、細胞、組織、個体という多階層からなり、内外の情報に適応しながら自立的に進化し自己組織化するシステムと捉える必要がある。本研究所前所長である多田富雄はこれを生命超(スーパー)システムと呼んだ。細胞においては最小機能単位(エレメント)である蛋白質、糖質、脂質、核酸などがゲノムプログラムと外部からの情報に応じて相互作用する結果、細胞の増殖、分化、機能発現あるいは死が誘導される。上位階層である組織(神経、免疫システムを含む)にとってのエレメントは主に細胞であり、細胞間相互作用は組織システムの発生、維持、活動として表現される。さらに臓器システムの相互作用は上位階層である個体の発生、成長、恒常性維持、活動、病気、老化、死として表現される。したがって、例えば、あるアミノ酸の変異が蛋白質分子の構造・性質を変化させ、その蛋白質の変化が細胞機能異常に、さらに細胞機能異常は臓器システムに、さらには個体の恒常性にと次々に影響を及ぼす。従って、人の病気を遺伝子配列の変化として捉えただけでは何の理解も得られないことは自明である。これを理解するために、階層毎の個々のエレメントの機能、エレメント間の相互作用とそれによるシステムの構築・活動の仕組みを明らかにし、さらに各階層のシステム間の関連づけを行う。これをデータベース化していくことで、生命超システムのコンピューターシミュレーションの基礎を築きたい。
1.生命超システムのエレメント
ヒトゲノム計画はほぼ終了し、マウスや他の動物についても全ゲノムの塩基配列解読が進行している。また、遺伝子転写物のcDNAの全てが解読されるのも時間の問題である。しかし、全遺伝子のコードする蛋白質の一次構造が解明されたとしてもそれは生命超システムを形成するエレメントを理解したことにはならない。その理由は、1)機能の知られている蛋白質と相似のものを除いて、一次構造からその機能を類推するのは極めて困難であること、2)遺伝子のコードするRNAや蛋白質以外に、脂質、糖質など様々の重要なエレメントが多数存在する、3)遺伝子のコードする蛋白質は糖付加、限定分解、リン酸化、アセチル化、メチル化など様々な修飾を受け、多様化する、4)複数の蛋白質が様々な組み合わせで複合し新たなエレメントを形成する場合がある、等である。このような理由から、われわれはエレメントを遺伝子ではなく最小機能単位と定義し、その機能を分子間相互作用と規定する。従って、蛋白質、脂質、糖質、複合体などを問わずあらゆる結合子がエレメントであり、全エレメントの集合はゲノムでもプロテオームでもなく、インタラクトームと考える。こうした普遍的な最小機能をエレメントと定義することによって、生命超システムのシミュレーションとその理解が可能となり、また、創薬の標的同定が容易となる。インタラクトームの全容を解明するために、ゲノム/cDNAデータベースを利用したモチーフ解析から蛋白質の機能ドメインを分類し、それぞれのドメインをもちいたtwo-hybrid 法、one-hybrid法、脂質アレイ等によりエレメントを同定していく。さらに包括的な解析として、モノクローナル抗体アレイを用いた同定法を開発する。理論的には蛋白質、脂質、糖質、複合体など全てのエレメントに特異的に結合するモノクローナル抗体を作製することが可能で、しかも、エレメント間の結合を阻止する抗体の活性をもって未知のエレメントをannotateすることができる。この原理を用いて、全エレメントの同定とannotationを行うための方法を開発する。
2.生命超システムの自立的進化機構
生命系の中で免疫系と神経系は個体内で急速な進化を遂げるという点でユニークなシステムである。免疫系においては抗原受容体遺伝子の再構成と体細胞変異による多様化と自己・非自己抗原という内外の情報による細胞の選択により、自己防衛に適したシステムへと進化する。神経系においても未知の機構による細胞の多様化と選択により内外の情報を処理し反応するシステムへの進化が起こる。これらはプログラムされている点において自立的といえるが、内外の情報により個体間で異なるシステムに変化していく点で発生とは根本的に異なる。この進化の機構を解明することは、「自己」という高次生命の謎に迫るだけでなく、自己免疫病、感染症、アレルギー、精神病といった難病の原因究明にもつながる。このような観点から現在行っている以下の研究を今後も強力に推進していく。
(1)抗原受容体からのシグナルによる抗原受容体遺伝子再構成の制御によって自己抗原に反応せず、異物に反応する抗原受容体の遺伝子が形成されることが明らかになってきた。この受容体シグナルから遺伝子組み換えに至る制御機構を解明する。
(2)免疫グロブリン遺伝子の体細胞突然変異を誘導する受容体シグナル経路、変異の遺伝子特異性を規定する機構、遺伝子の塩基置換のメカニズムを解明する。
(3)胸腺内分化過程において自己MHCに結合し、かつ自己抗原ペプチド+自己MHCに結合しないT細胞のみが選択される。この選択に関わるT細胞抗原受容体(TCR)の抗原/MHC認識機構、シグナル伝達機構を解明する。
(4)免疫系の解析結果を適用して、神経系の自立的進化機構の仮説(遺伝子変異、細胞多様化と選択など)を立て、これを検証する。
3.生命超システムの自己組織化機構
発生の過程で細胞はゲノムに書かれたプログラムに従って増殖、分化あるいは死を繰り返して最終的に一定の大きさと構造を有した臓器を形成する。血液系細胞も一定の数と細胞系列の比率を保ったシステムを形成する。また、臓器システムの一部が欠損した場合、または、感染炎症などにより構築に異常をきたした場合も、組織再生により元のシステムを復元しようとする。個々の細胞はシステム全体を知ることはできないのに、最終的に一定の構築を形成するのは大きな謎である。この自己組織化の異常として免疫不全症、自己免疫病、アレルギー、癌、老化を捉えることができる。また個々の細胞の分化に加えて自己組織化の機構を知ることは再生医療にも不可欠である。この自己組織化の解明に向けて、主に免疫系と骨組織をモデルとして以下の研究を行う。
(1)臓器システムの自己組織化はそのエレメントである細胞の相互作用を基礎としているに違いないので、それに関わる膜リガンド−受容体系、サイトカイン−受容体系を同定し、それらの相互作用を干渉する抗体や試薬により、あるいは、それらの遺伝子ノックアウトマウスを作製することにより、自己組織化におけるそれらの役割を明らかにする。また同時に自己組織化の異常の動物モデルを作製する。プレB細胞受容体、抗原受容体、B7-1/B7-2/B7h - CD28/CTLA4/AILIM、IL-2, IL-4, IL-12, gIFN, TGFb, BMP, MIF等サイトカインとそれらの受容体、Delta−Notch、細胞外マトリックス等については現在研究が進展している。
(2)プログラムされた、あるいは細胞相互作用によって制御される細胞分化の多くは遺伝子発現によって制御される。そこで特異的に発現する遺伝子の発現制御領域(エンハンサー、LCRなど)を決定し、そこに作用する転写因子を同定し、その作用機序を解明する。また、転写因子の活性化を誘導するシグナル伝達機構を解明する。さらに、原子間力顕微鏡を用いて、転写因子とDNAの結合あるいはクロマチン構造を可視化する技術を確立する。
(3)自己組織化において細胞の増殖、分化とともにアポトーシスは不可欠の要素であるが、自己組織化に伴うアポトーシスの誘導機構や実行機構はまだ不明の部分が多い。現在、アポトーシスに伴いDNA断片化を起こす核内エンドヌクレアーゼの役割を、in vitro細胞分化系あるいは変異マウスを用いて調べている。また、アポトーシスと増殖という相反する細胞反応を誘導するNotchシグナルのメカニズムについても解析を進める。さらに免疫系細胞の分化と選択においてアポトーシスを決定する受容体シグナル伝達機構を明らかにする。
(4)以上の知見をもとにして、免疫システムあるいは骨システムにおける細胞の増殖、分化、死の時間的・空間的制御様式をコンピューターシミュレーションする試みを行う。
4.生命超システムの情報処理機構
上述のように、臓器システムの自己組織化においては細胞相互作用による情報が細胞の増殖・分化・死などを制御して組織化が進行する。くわえて免疫系や神経系においては、外部からの情報を適切に処理してこれに対応することがそれぞれのシステムの大きな役割である。免疫系は様々な病原体や異物をすばやく認識しこれを排除するシステムであり、神経系は感覚器からの情報を分析・処理し、これに応答する。どちらも学習と記憶によりその能力が向上する。これらにおいては個々の細胞そしてシステムとしての情報処理能力が重要であり、その異常は免疫不全症、自己免疫病、神経病、痴呆などとして現れる。この情報処理機構を解明することはこれらの病気の原因解明および治療にとっても重要である。
細胞レベルでの情報処理は細胞上の受容体による認識に始まり、細胞内シグナル伝達を経て、核内での遺伝子転写誘導など細胞内の変化が起こり、細胞の増殖分化や効果発現に至る。このような個々の細胞の反応がサイトカインや細胞間相互作用によって組織化され、システムとしての情報処理となる。したがって、ここでは細胞の受容体シグナル伝達機構およびシステムとしての情報処理の分子メカニズムを研究する。個々の分子機能と細胞反応、さらにはシステムの応答との関連付けは、生体情報処理システムのシミュレーションや薬理効果の推測に重要な作業となる。
(1)受容体のリガンド認識の解析:抗原と抗原受容体の結合力が抗原の大きさや構造、抗原決定基の数、抗原受容体の構造によってどのように決定されるか、また、MHCと抗原ペプチド、TCRの構造と結合力との関係を物理化学的に明らかにする。そして、その結合力の違いがシグナル伝達や細胞反応にどう反映されるかを細胞レベルで調べ、さらに免疫応答やトレランスなど免疫システムの機能にどう反映されるかを個体レベルで調べる。
(2)受容体シグナル伝達機構:サイトカイン受容体シグナル伝達とフィードバック、分化誘導機構を解析する。抗原受容体による分化・増殖制御、アポトーシス誘導といったシグナル経路の多様性とその選択機構を解明する。CD28, AILIMといった副受容体、CD72等の抑制性受容体のシグナル経路と抗原受容体シグナル経路とのクロストークの仕組みを解明する。マスト細胞上のIgE受容体から脱顆粒、サイトカイン産生に至るシグナル経路を解明する。これらのシグナル経路の選択的欠陥が免疫システムの機能に与える影響を個体レベルで調べる。
(3)システムとしての情報処理機構:記憶B・T細胞の形成維持とその高速応答のメカニズムを解明する。抗原の性質に応じて細胞性免疫応答と液性免疫応答とのバランスを決定するTh1・Th2細胞の分化・活性化のメカニズムを解明する。免疫応答を制御する抑制性T細胞の特性・機能を解明する。免疫応答システムにおけるこれら細胞エレメントの役割を明らかにする。

5.生命超システムの破綻(病気)と創薬展開
個々のエレメントの欠損や異常発現による細胞機能の異常、臓器システムの異常、さらに個体の異常(病気)をノックアウトマウス・トランスジェニックマウス等を用いて解析し、ひとの疾患との比較の上で、発病から進展、治癒あるいは死へと至るまでのメカニズムを、シミュレーションを含めて理解する。その上で創薬のターゲットとなるエレメントを決定し、その立体構造を解析する。それをもとに分子ミメティックスあるいはProgressive Drug Designの手法により化合物をデザイン・合成し、エレメント間相互作用を利用したアッセイ系によりスクリーニングした上で、細胞系、さらに動物を用いてその薬効を評価する。


