研究内容
B細胞初期分化の制御機構
B細胞は造血幹細胞から発生し、プロB細胞、プレB細胞を経て、B細胞へと分化します。ヒトやマウスなど多くの動物では、胎児期には主に肝臓で、生後は主に骨髄でこのB細胞初期分化が起こります。B細胞の初期分化で最も特徴的なことは抗体(免疫グロブリン:Ig)遺伝子の再構成が起こることです。まず、H鎖遺伝子領域にある多数のV, D, Jの遺伝子断片からそれぞれ1つずつがランダムに選ばれてDNA組み換えにより結合し、VDJというひとつのエクソンを形成します。この過程はプロB細胞で起こり、この再構成に成功したH鎖遺伝子からはμH鎖蛋白が作られます。μH鎖蛋白はそれ以前に発現していたVpreBおよびλ5というふたつの蛋白とともに複合体(プレB細胞受容体:pre-B cell receptor, preBCR)を形成します。VpreBとλ5はあわせてL鎖様の構造をもっているので代替L鎖(surrogate light chain)とも呼ばれますが、B細胞以降の分化段階では発現していません。preBCRが細胞膜上に発現すると細胞分裂が起こり、RAG活性の低下によりH鎖再構成が止まり、細胞数が増えます。この段階の細胞を大型プレB細胞と呼びます。実際にはほとんどの大型プレB細胞はpreBCR陰性です。これはpreBCRが細胞表面に発現している時間が非常に短いためと考えられています。数回の細胞分裂の後、分裂は停止し、細胞は小型プレB細胞となります。この細胞ではL鎖(κ / λ)遺伝子のV-J再構成が起こります。これに成功した遺伝子から作られるL鎖蛋白はμH鎖と一緒にIgMを形成して、細胞膜上に発現します。ここでついにIgMという抗原受容体を持ったB細胞が誕生します*。次にB細胞はこのIgMと同じ抗原特異性を持つIgDをも発現し、骨髄から末梢リンパ組織へと移行します。末梢ではさらに、IgMよりIgDの発現が高い成熟B細胞へと分化します。
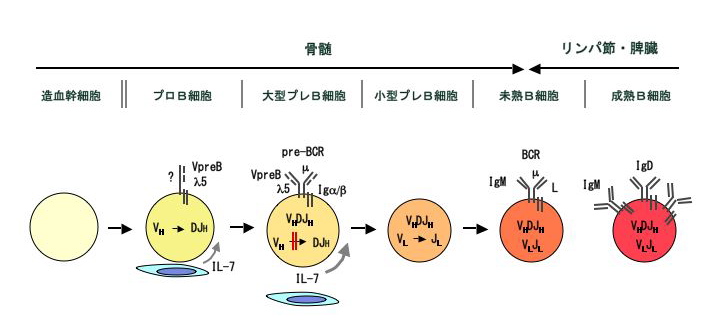
preBCRを細胞表面に発現している細胞は非常に少ないのですが、膜型μ鎖変異マウスではB細胞分化がプレB細胞の手前で停止しているので、やはり細胞膜上にpreBCRが発現して細胞内にシグナルを送ることが重要だと考えられます。preBCRを構成する膜型μ鎖、λ5、VpreBのそれぞれのノックアウトマウスの解析から、preBCRには以下のような機能があることが明らかになっています。
1) IgH鎖遺伝子再構成の抑制(対立遺伝子排除)
2)プレB細胞の分裂・増殖
3)細胞表面のpreBCRの消失
4)大型プレB細胞から小型プレB細胞への分化
5)L鎖遺伝子再構成の促進
これらの機能の生理的な意味について以下に説明します。
1) 一方のH鎖対立遺伝子(アレル)がV-DJ結合に成功し機能的なμH鎖を発現するともう一方のアレルの再構成を抑制するというもので、B細胞の「1細胞―1特異性」の原則を確立するのに重要な機構です。いま、DJ結合まで進んだH鎖遺伝子の2つのアレルが自由にV-DJ再構成できるとすると、VとDJのコドンの読み枠が一致する確率は1/3だから、ごく単純に考えて1/9の確率で両方のアレルが機能的なH鎖遺伝子を作ってしまいます。一方、両方のアレルがともに非機能的なH鎖遺伝子を作る確率は2/3×2/3=4/9で、このような細胞は抗原受容体を発現しないのでB細胞にはなれません。したがって、産生されるB細胞のうち2つの機能的なH鎖遺伝子をもつ細胞は1/9÷5/9=1/5となります。すなわち、対立遺伝子排除の機構がなければ、20%のB細胞のそれぞれが2つの異なるH鎖を発現してしまい、2つの抗原特異性を持つことになります。これらの細胞がある抗原に出会ってそれに対する抗体を産生するようになると、もうひとつの無関係の特異性を持つ抗体も産生されて、免疫応答の特異性が失われてしまいます。
2) 機能的なH鎖蛋白ができたことをチェックし、その機能的な細胞を選択的に増加させるのに役立っています。DNA組み換えによるIg遺伝子再構成は成功より失敗の方がはるかに多いプロセスですから、限られたスペースの中で再構成に成功した有意義な細胞を選択することは重要です。
3) preBCRはλ5とVpreΒを介して自己架橋することにより細胞内にシグナルを送るとともに、エンドサイトーシスによって細胞内に取り込まれます。その後はλ5,VpreΒの遺伝子発現が無くなることによってpreBCRの再発現が抑止されます。preBCRの消失はプレB細胞の増殖停止をもたらすと考えられていましたが、最近、preBCR を持続的に発現させたトランスジェニックマウスでもプレB細胞の増殖・分化は正常であることが示されました。一方、このマウスではB細胞が自発的に活性化し抗体を産生することから、preBCR からの恒常的シグナルはB細胞の正常な制御を妨げると考えられます。
4) 分化が進行することが重要なのはいうまでもありませんが、ここでは分裂が停止して小型プレB細胞へ分化し、RAG-1/2(Ig遺伝子再構成に必須の酵素)の活性が再上昇し、L鎖遺伝子の再構成が開始されることも重要です。もし、H鎖とL鎖の遺伝子が同時期に再構成すると失敗の確率は相乗的に高くなるはずですから、すでに機能的H鎖を有する細胞においてL鎖遺伝子再構成が開始されることが効率を高めるのに重要だと思われます。
5) preBCRを発現できないノックアウトマウスでもL鎖遺伝子の再構成は起こりますが、その頻度は低いことから、preBCRシグナルはL鎖遺伝子の再構成を促進すると考えられます。preBCRシグナルはRAG-1/2の発現を低下させる一方で、L鎖遺伝子領域の転写(Germline transcript)を促進し、再構成のための組換え酵素を受け入れやすい状態にすると考えられています(Accessibility model)。
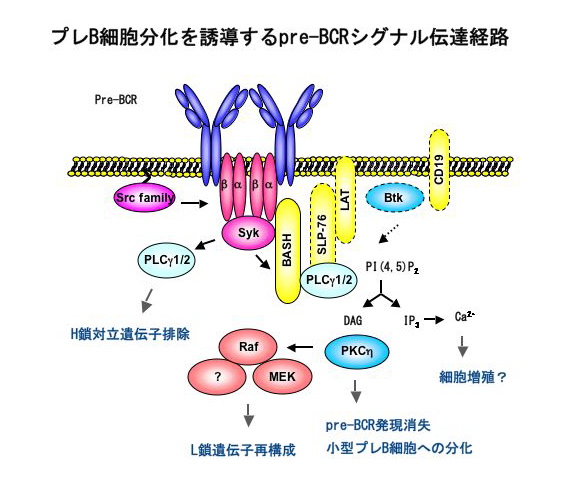
このように重要な機能を担うpreBCRですが、そのシグナル伝達機構はまだ十分に理解されていません。私たちはこれらの異なる機能がどのようにして引き起こされるのか、それがpreBCRからどのようなシグナル経路で伝達されるのかということを、分子レベルで明らかにしたいと考えています。これまでの研究から、preBCRのシグナル伝達に関わるシグナル因子のほとんどは抗原受容体(BCR)シグナルのものと共通だと考えられています。しかし、それらのノックアウトマウスはBCRシグナルによるB細胞の活性化異常を示すものがほとんどで、プレB細胞の手前で分化停止を示したのはSykノックアウトマウスだけです。Sykはシグナル伝達の起点ともいうべきチロシンキナーゼで種々のシグナル因子をリン酸化しますが、そのうちどの因子がどの経路に働いているのだろうかというのが私たちの疑問です。私たちが作製したBLNK(別名SLP-65/BASH)の欠損マウスではB細胞初期分化が不完全で、少数のB細胞は存在するものの、骨髄では小型プレB細胞が消失し、代わりに大型プレB細胞が蓄積していました。おもしろいことに、この大型プレB細胞は通常見られないpreBCR陽性の細胞で、しかも細胞回転がほとんど停止していました。したがって、分化誘導に必要なpreBCRのシグナル伝達にはBLNKが関わっており、preBCRを発現してもBLNKがないと細胞分裂がうまく誘導できず、その段階で分化が停滞してしまったと考えられます。また、preBCRの細胞表面からの素早い消失にもBLNKを介したpreBCRシグナルが関与している可能性も示唆されます。しかしながら、H鎖対立遺伝子排除は骨髄でも末梢でも正常であり、2種類のH鎖を発現しているプレB細胞やB細胞はありませんでした。このことから、シグナル経路はすでにBLNKのところで少なくとも2つに分岐していることが明らかとなりました。
驚いたことにBLNKノックアウトマウスの数%にはプレB細胞由来の白血病が発症しました(「プレB細胞性急性リンパ性白血病の発生機構」の項参照)。私たちは発症したマウスの骨髄細胞を長期培養することによりこの白血病由来のプレB細胞株を数株樹立しました。これらの細胞はpreBCRを発現しており、BLNKの導入や抗体によるpreBCRの強架橋によって、preBCRの消失とL鎖遺伝子の再構成、L鎖発現が誘導されることがわかりました。このプレB細胞株はこれらのイベントを引き起こすpreBCRシグナル伝達経路を解明するのに有用なツールとなると私たちは考えました。そして研究の結果、BLNKから蛋白キナーゼであるPKCηを介するシグナルが転写因子IRF-4の発現を誘導して、その結果、preBCR発現停止、L鎖遺伝子領域の転写(Germline transcript)および再構成を促進することが明らかになりました。
一方、H鎖対立遺伝子排除を起こすpreBCRシグナルにはSykやPLCγ2は必要ですが、BLNKやBtkは必要でなく、PLCγ2以下のシグナル経路は今のところ分かっていません。
注 * 再構成に成功したひとつの免疫グロブリンH鎖遺伝子から転写されたRNA(VDJ-Cμ)から異なるスプライシングにより2種類のmRNAができ、そこから膜型μH鎖と分泌型μH鎖とが翻訳されます。前者がL鎖と結合したものが抗原受容体で、後者がL鎖と結合したものが抗体です。B細胞が抗原と出会うまでは前者のmRNAがほとんどで、抗原受容体(膜型IgM)が細胞表面に発現していますが、抗原刺激を受けるとスプライシングのパターンが変化し、後者のmRNAが急増して、分泌型のIgM抗体が大量に産生されるようになります。また、IgDのH鎖であるδ鎖も同じH鎖遺伝子から産生されますが、μH鎖mRNAがVDJとCμ遺伝子とのスプライシングによるのに対し、δ鎖mRNAはVDJとCδ遺伝子とのスプライシングにより作られます。
お暇ならこちらも → 「抗原を認識する、故にB細胞在り」
Back


