抗原を認識する、故にB細胞在り
「我思う、故に我在り」という通り、人間のアイデンティティーは脳が思考することによって生じ、その思考パターンが人間の個性であるといえる。一方、リンパ球のアイデンティティーを決めているものは抗原受容体である。アイデンティティーが明確でない人間は多いが、アイデンティティーを確立できないリンパ球はその存在を許されない。すなわち抗原受容体をまともに発現できないリンパ球はすべて発生の過程で分化の進行が止まり、死の運命を辿る。B細胞系列では、μH鎖とVpreB, λ5から成るプレB細胞受容体(preBCR)が膜蛋白として発現することによってまず抗原受容体H鎖の発現がテストされる訳である。今では免疫学の常識となったが、これを初めて明確に示したのはKlaus Rajewskyの研究室で私たちが作製したμH鎖遺伝子膜エクソンおよびλ5遺伝子の変異マウスの表現型であった。両者の骨髄では、小型プレB細胞より前の段階で分化が停止していた。それ以前には、プレB細胞株の培養系で膜型μH鎖がごく低頻度にL鎖遺伝子の再構成を誘導することが示されていただけで、プレB細胞にμH鎖のみが発現していることの意味は明らかでなかった。しかし、プレB細胞特異的に発現するL鎖様遺伝子λ5、VpreBが同定され、それらの産物がμH鎖と結合しうることもわかり、これらの発見が黎明期のジーンターゲティング技術と見事に融合してリンパ球初期分化のパラダイムとして実を結んだというわけだ。T細胞初期分化も同様にb鎖を含むpreTCRによって制御されることが間もなく明らかにされた。
preBCRの細胞膜上での発現はいくつかの細胞株では明らかだが、骨髄内のプレB細胞では未だにはっきりしない。プレB細胞の数が少ない上にpreBCRの発現量も少なく、また一過性であることが検出を困難にしていると思われる。正常プレB細胞上でのpreBCRの発現を疑問視する声もあったが、BCRシグナル伝達の中軸であるIgα/βやSykキナーゼの変異マウスもpreBCR欠陥マウスと同様の表現型を示したことから、BCRと同様にpreBCRも細胞膜上からシグナルを発して分化を誘導していると考えられる(以前の報告と異なり、Igβ変異マウスでもVDJ再構成まで分化は進行し、また、Igα null変異マウスでもμH鎖変異マウスと同じ段階で分化が停止するそうである;私信)。preBCRあるいはpreTCRの欠陥によって停止したB・T細胞初期分化がIgβやCD3の架橋により回復することもこれを強く支持する。次はこのpreBCRからのシグナルがどのように伝えられているかである。preBCRはプレB細胞の分裂とその後の小型プレB細胞への分化だけでなく、H鎖遺伝子再構成の抑制(対立遺伝子排除)やL鎖遺伝子再構成の促進(異論はあるが)にもシグナルを送っているとされている。このシグナル経路がどのように振り分けられ伝えられているのかを明らかにするのが私たちの現在の研究目標のひとつである。主にB細胞株を用いた研究から、Syk, Lyn, Btkといったチロシンキナーゼとそれらの基質となるPLCγ2, Vav, PI3-kinase, Shc, HS1, その他Grb2, Ras, Racといった蛋白がBCRシグナル伝達の初期に関与すると考えられているが、そのうちノックアウトマウスの解析からpreBCRシグナルによるB細胞初期分化に働いていることが明らかになったのは意外にもSykのみである*。
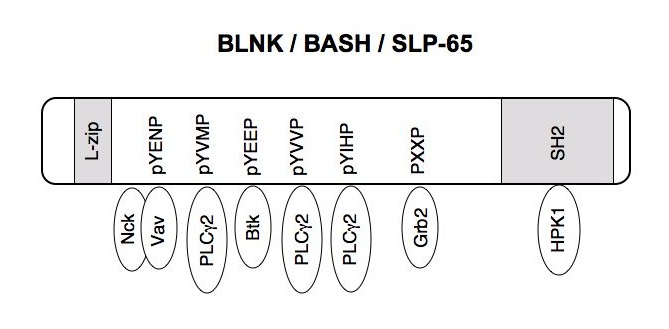
私たちがニワトリのファブリキウス嚢からPCR-サブトラクション法により同定したB細胞特異的に発現する蛋白BASH (B-cell adaptor containing an SH2 domain) は、TCRシグナル伝達に重要なアダプターとして注目されていたSLP-76とよく似た構造をしていて、実際、BCR架橋によりチロシンリン酸化されSykと会合するなど、SLP-76と同様にBCRの下流でシグナル分子のアダプターとして機能していると考えられた。また、BASHのマウスホモログと思われる不完全なcDNAをデータベースに見出し、その全長をクローンした。これでBCRシグナル伝達研究をbreak throughできるのではと興奮し、すぐにDT40細胞とマウスのミュータント作りやin vitroの実験にとりかかった。しかし、驚くべきことに同じことをやっているグループが他に3つもあることが後に判明した。Andy ChanのグループはBCR刺激後、PLCγ2, Vav, Grb2, Nckと結合するリン酸化蛋白をヒトB細胞から精製単離しBLNK (B-cell linker) と名付けた。また、Michael RethのグループはBCRの発現に依存してpervanadate処理により最も早期にチロシンリン酸化されるマウス蛋白を精製単離しSLP-65と呼んだ。さらに、黒崎知博先生らは独自にニワトリBLNKを単離し、BLNK欠損DT40細胞を作製して、BLNKがPLCγ2の活性化に必須であることを証明した。同時期にひとつの蛋白がBASH, BLNK, SLP-65という3つの名前で呼ばれていたことになる。Publicationの順番を尊重して現在はBLNKと呼ぶ。
この分子のノックアウトマウスもそれぞれの命名者(+ Kong-Peng Lam)のグループで作製されたが、末梢リンパ系の表現型は、成熟B細胞や腹腔B-1細胞の激減、BCR刺激に対する活性化・増殖反応の欠如、T細胞非依存性抗原への免疫応答の欠如など、Btk変異マウス**と酷似した。ところが、骨髄の表現型はBtkあるいは preBCR欠陥マウスとも異なり、小型プレB細胞が無く、そのかわりCD43の発現がやや低下し、しかも表面preBCR陽性というこれまであまり見えなかった大型のプレB細胞が蓄積していた。正常の大型プレB細胞はpreBCRシグナルにより増殖サイクルに入っているが、このプレB細胞はほとんどがG0/G1期で停止していた。この結果から、BLNKはプレB細胞の分裂とその後の小型化を誘導するpreBCRシグナル伝達に必要であるとわかった***。
H鎖対立遺伝子排除にはBLNKは必要ないので、SykによるシグナルのすべてをBLNKが伝達するわけではないようだ。preBCR陽性細胞が蓄積しているということはpreBCRのdown regulationにもBLNKを介したpreBCRシグナルが働いていると考えられる。また、小型プレB細胞が無いにもかかわらず新生B細胞は結構あるので、L鎖遺伝子再構成は大型プレB細胞でかなりの頻度で起こっていると思われる。これはRAGのdown regulationが起こらないためだろうか。さらに、自己抗原に反応してreceptor editingを起こしている新生B細胞は正常では小型プレB細胞と見なされているのだが、小型プレB細胞が無いこのマウスではいったいreceptor editingは起こっているのだろうか。もし起こらなければ、このマウスは自己免疫病になるのだろうか。ようやくコロニーが樹立できたC57BL/6純系のBLNK欠損マウスを詳細に解析することによって、今後これらの疑問を解決していきたい。また、BtkもPLCγ2も必要でないとすればBLNKがどのようにpreBCRシグナルを下流に伝えているのだろうか。これについても、私達が見出したBLNKのSH2ドメインに結合して活性化されるHPK1の機能も含めて、BLNKを介するシグナル伝達機構を明らかにしたい。リガンドを必要としないこの似非受容体のシグナル伝達様式はこれまでの常識からずいぶん外れたものなのかも知れない。
注* ヒト男児に発症する遺伝性B細胞性免疫不全症(X-linked agamma-globulinemia: XLA, Bruton病)ではB細胞分化がプレB細胞で停止しているが、その原因はBtk遺伝子の変異である。したがって、ヒトではpreBCRシグナル伝達にBtkが主要な働きをしていることは明らかである。
注** 数少ない免疫系の自然変異マウスのうち、成熟B細胞が少なく、その機能も低下しているマウス(X-linked immunodeficiency: Xid)が知られていたが、その原因遺伝子がBtkであった。後に作製されたBtk遺伝子ノックアウトマウスもまったく同じ表現型であった。
注*** BLNK遺伝子に変異を持つ患者では、B細胞初期分化がプレB細胞で完全に停止していた。したがって、Btkと同様、ヒトにおいてはBLNKはプレB細胞の分化を誘導するpreBCRシグナルに必須である。
(特定領域研究「免疫シグナル伝達」ニュース、No.3, 平成12年12月掲載稿)
(一部改変)
Back

