研究内容
多様な反応を誘導するB細胞抗原受容体シグナル経路の解明
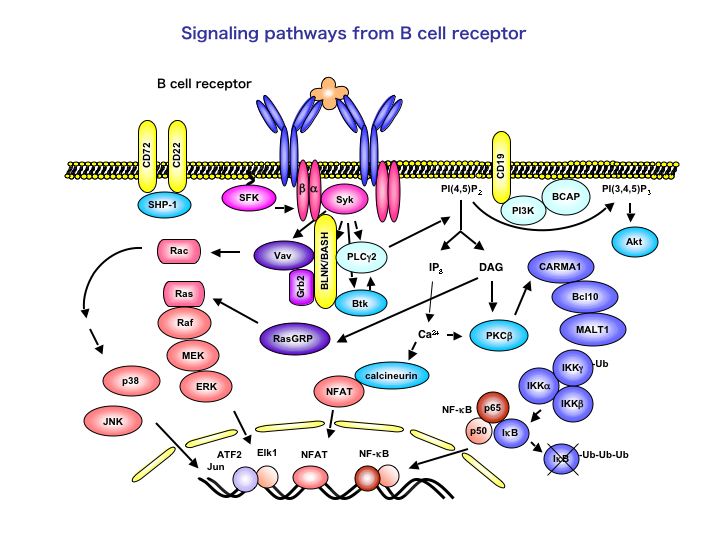
抗原受容体(B cell receptor: BCR)が抗原に出会うと、B細胞は抗体産生細胞か記憶細胞に分化して免疫応答に活躍します。ここでも、細胞の活性化、様々な蛋白の発現、細胞増殖あるいはアポトーシス、そして分化方向の決定と、様々なイベントが起こります。一方、生まれたばかりのB細胞が抗原と出会うと、これを自己抗原と見なして、B細胞は不活性化されたり(anergy)、BCRを交換したり(receptor editing)します。こうして自己反応性のB細胞があらかじめ除かれることは免疫系の自己寛容の成立に重要です。このように様々な細胞の反応がどうやって同じBCRから惹起されるのでしょうか。私達は、BCRシグナル経路が途中で多岐に別れ、それぞれがうまくコントロールされることによって、異なる様々の反応を導くと考えています。この複雑なシグナル伝達の仕組みを解き明かしたいと思っています。現在、特にアダプター分子BLNKを中心においてシグナルを考えています。BLNK(別名SLP-65/BASH)はB細胞特異的に発現するアダプター蛋白で、BCRが抗原に刺激されるとチロシンリン酸化され、様々な分子と結合し、下流へとシグナルを伝えます。これまでに、BLNKがBtkおよびPLCγ2と結合することにより、PLCγ2のリン酸化および活性化を仲介すること、VavおよびGrb2と結合しVavによるRac1の活性化を促進すること、NF-ATやNF-κBなどの転写因子の活性化に必要であることが明らかになっています。T細胞その他の造血系細胞に発現するSLP-76、マスト細胞と活性化T細胞に発現するMIST(別名Clnk)とは構造や機能が良く似ていて、ひとつのアダプター分子ファミリーを形成しています。
In vivoのアプローチとしては、BLNKのノックアウトマウスを色々な方法で解析して、抗体産生や記憶形成、B細胞性自己寛容にどういう異常が現れるかを調べます。これまでにわかったことは、BLNKノックアウトマウスでは、成熟B細胞と腹腔のB-1細胞が著しく減少し、残ったB細胞は死にやすく、抗原受容体を刺激してもほとんど活性化も増殖もしません。マウスの血清中の抗体価は正常の1/10かそれ以下で、T細胞非依存性抗原で免疫した場合はそれに対する抗体をほとんど産生しません。しかし、蛋白などT細胞依存性抗原に対してはIgMクラス以外は正常に抗体を産生しました。これらのことから、B細胞の成熟、活性化、増殖を誘導する抗原受容体からのシグナル伝達にBLNKが重要な役割を果たしていることが明らかになりました。抗原受容体のもうひとつの重要な働きである自己トレランスの誘導、すなわち、receptor editing*がBLNKノックアウトマウスではうまく起こっていないこともわかりました。
BLNKノックアウトマウスを胸腺非依存性抗原(T細胞を必要としない多価抗原)で免疫してもそれに対する抗体を産生しません。一方、胸腺依存性抗原(T細胞を必要とする蛋白質抗原)を免疫するとIgM型抗体はほとんど産生しませんが、IgG型抗体は正常と比べると随分遅れますが、ある程度産生します。さらに追加免疫をしますと、今度は正常マウス以上にIgG型の抗原特異的抗体を産生します。この抗体には正常に体細胞突然変異が入っており、抗原に対する親和性は十分に高くなっています。すなわち、最初は抗原に反応するB細胞クローンの増殖が遅くその数が少ないのですが、ゆっくりと増えていって、2度目の免疫には正常な応答ができるようになるということです。ここから、T細胞ヘルプを必要とするクラススイッチ、体細胞突然変異、高親和性クローンの選択、記憶形成などの過程にBLNKを介したシグナル経路は必要ではないということが分かります。面白いことに、BLNKノックアウトマウスの半数程度では、抗原特異的IgGの産生が免疫後1年たってもずっと高いままで、骨髄には抗体産生細胞(長期生存プラズマ細胞)が異常に多く存在しています。また、3度目の免疫をすると、正常マウスよりも高い抗原特異的IgGを産生します。すなわち、抗原特異的記憶B細胞の数が多い(あるいはクローン増殖が大きい)と考えられます。このことから、一度抗原に応答したB細胞では、次のBCR刺激による細胞増殖・分化においてBLNKはむしろBCRシグナル伝達に抑制的に働くと考えられます。これはB細胞の活性化によるBCRシグナル伝達経路の変換を意味するのか、あるいは、IgM型BCRとIgG型BCRのシグナル伝達経路の違いによるものか、そしてBLNKがそこにどう関わるのか、これらのことを明らかにするために現在研究を続けています。
脾臓やリンパ節において抗原に反応したB細胞が増殖し胚中心と呼ばれる構造を形成します。この胚中心において高親和性のB細胞クローンが選択され、その中から記憶B細胞や長期生存プラズマ細胞が分化していきますが、そのような選択や分化のメカニズムはほとんど分かっていません。これを明らかにしていくために、B細胞を胚中心様の細胞として増殖させる培養系を作製しました。この系を用いて、今後は、体細胞突然変異の誘導シグナル、高親和性クローンの選択や分化方向の決定のメカニズムを明らかにして行きたいと思っています。
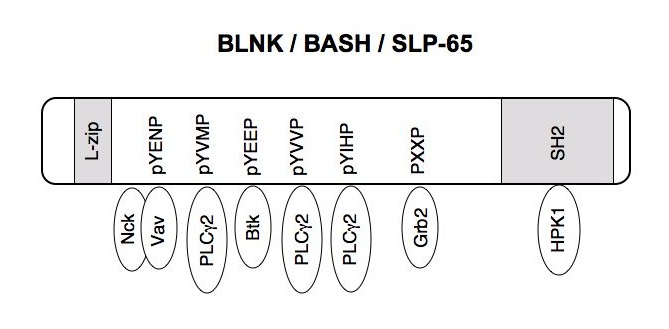
In vitroのアプローチとしては、BLNK欠損B細胞を生化学的に解析し、シグナル伝達におけるBLNKの役割、作用機序を明らかにします。また、BLNKと結合する蛋白を同定してその役割を調べています。まず、Ste20ファミリーに属するMAP-KKKKであるHPK1が、チロシンリン酸化された後BLNKのSH2ドメインに結合して活性化することを見出しました。HPK1はMAPKやNF-kBの活性化に関与すると言われていますが、B細胞ではBCRシグナルによるNF-κBの活性化を促進することがわかりました。さらにYeast two hybrid法を用いて、新規のBLNK結合蛋白(BNAS1, BNAS2と命名)を同定しました。おもしろいことに、独立に同定されたBNAS1とBNAS2はどちらも4回膜貫通蛋白質でした。これらの新規膜蛋白の機能を明らかにし、BLNKを介した新しいシグナル制御機構を見つけたいと思います。
注* 自己抗原と結合して強いシグナルを受けたB細胞はすでに完成しているL鎖遺伝子領域に再びV-J再構成を起こし、新しいL鎖遺伝子を作るとことができます。こうして抗原受容体の特異性を自己に反応するものから別のものに変更することをreceptor editingと呼びます。
Back


